Indledning
Denne vejledning er skrevet til indkøbsledere, brandstiftere og compliance-chefer, der indkøber tandpasta, mundskyl og blegemidler, og som er ansvarlige for at få mundplejeprodukter godkendt og på hylderne. Revisioner og compliance af mundplejeprodukter er de vigtigste årsager til lanceringsforsinkelser, toldforsinkelser, ommærkningsomkostninger og mislykket onboarding i detailhandlen – ikke formuleringskvalitet.

Mundpleje ansigter strengere kontrol end generel kosmetik på grund af aktive stoffer, påstande og sporbarhed af batcher, og en 4-ugers toldtilbageholdelse kan fange et sekscifret minimumsbeløb for kontanter. Denne artikel gennemgår region-for-region revisionslogik, mundplejespecifikke krav og klare OEM- vs. importøransvar.
På Oralabx, vi arbejder specifikt med brands på dette fejlpunkt – hvor formuleringen måske er klar, men hvor overholdelse af reglerne afgør, om en SKU rent faktisk når markedet.
Hvordan mundhygiejneaudits rent faktisk fungerer (obligatorisk vs. valgfri)
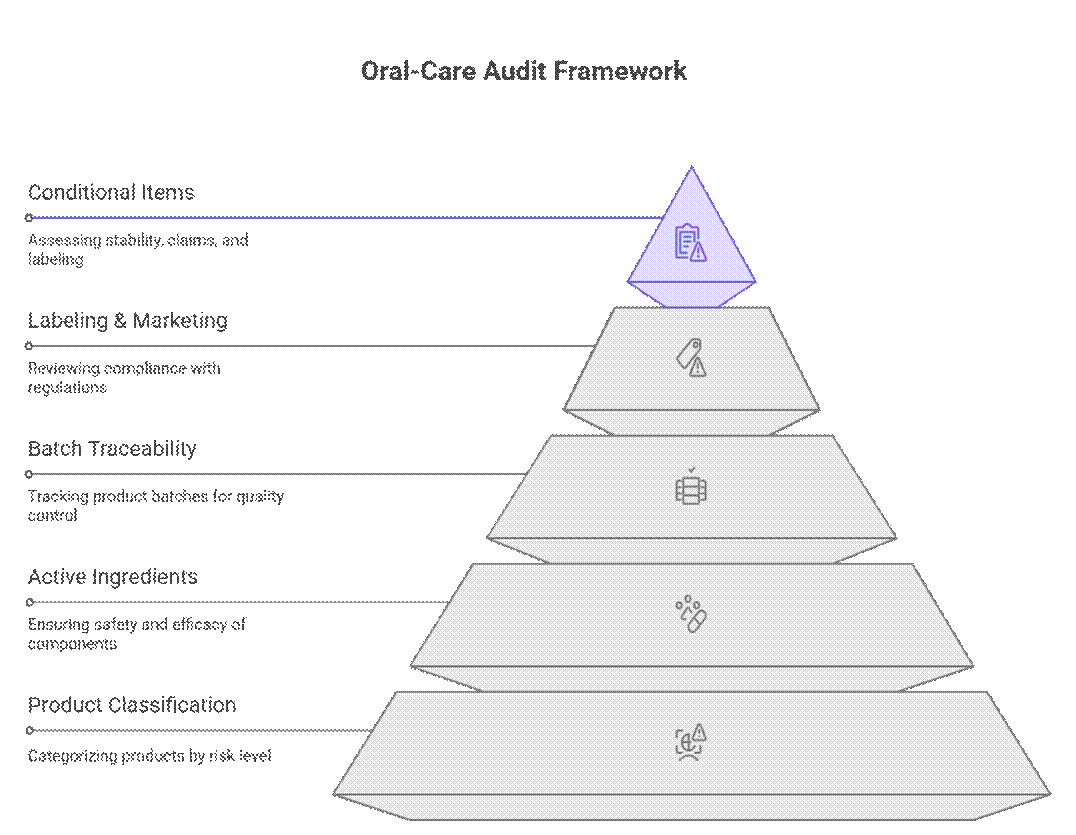
Regulatorer håndterer revisioner og overholdelse af mundplejeprodukter ved hjælp af en niveaudelt, risikobaseret ramme, der prioriterer produktklassificering, aktive ingredienser og batchsporbarhed før mærkning eller markedsføringsgennemgang. Først efter at disse er bestået, gennemgår de betingede punkter som stabilitetsvarighed, dokumentation af påstande eller overgangsmærkning.
Hvad revisorer tjekker først (ikke til forhandling)
Revisorer starter med et strengt sæt krav, der skal være opfyldt, før yderligere gennemgang kan fortsætte.
- Produktklassificering (kosmetik vs. håndkøbsmedicin / kvasi-lægemiddel)
Fejlklassificering er fortsat en af de mest almindelige fejl i revisionskravene for tandpasta, især når mærker misforstår klassificeringsgrænserne for mundplejeprodukter, nemlig kosmetiske produkter versus håndkøbsprodukter, knyttet til aktive ingredienser og anprisninger.
- Tærskler for aktive ingredienser
Verificerer overholdelse af grænseværdier for ingredienser som fluorid eller CPC, hvilket kan udløse tilsyn på håndkøbs- eller lægemiddelniveau.
- Producentregistrering og GMP-status
Sikrer, at OEM-anlægget er korrekt registreret og opererer under godkendte GMP-standarder for produktion af mundpleje.
- Batchsporbarhed og tilbagekaldelsesparathed
Bekræfter, at der findes komplette batchregistre for hurtigt at kunne spore, isolere og tilbagekalde produkter, hvis det kræves af myndigheder eller detailhandlere.
Hvad er betinget påkrævet
Ud over de ufravigelige punkter anvender revisorer en risikobaseret gennemgang af dokumentation og testning. Håndhævelsen varierer afhængigt af markeds- og produktrisiko, men mangler fører ofte til forsinkelser eller betingede godkendelser.
- Stabilitetsvarighed (accelereret vs. realtid)
Accelereret stabilitet kan være tilstrækkelig til tidlige eller lavrisikolanceringer, men realtidsstabilitet er ofte påkrævet for produkter med aktive ingredienser, længere holdbarhed eller strengere markeder som EU eller GCC. Stærke OEM'er kører realtidsstabilitet parallelt.
- Påstandens underbyggelsesdybde
Grundlæggende kosmetiske påstande kræver normalt minimal begrundelse, mens påstande om ydeevne kræver laboratorie- eller kliniske data. Revisorer markerer påstande, der mangler beviser eller ikke stemmer overens med den endelige formulering.
- Lokalt sprog og mærkningsformater
Engelsk etikettering kan muligvis godkendes, men den endelige godkendelse kræver normalt mærkning på det lokale sprog, der overholder reglerne. Revisorer markerer ofte manglende underetiketter, forkerte ingrediensnavne eller risikable oversættelser af påstande.
Hvad kan forhandles (med en stærk OEM)
Selvom reglerne synes rigide, anerkender erfarne revisorer de praktiske produktionsforhold. Med en dokumenteret OEM og en klar compliance-køreplan kan nogle krav fases eller sekventeres uden at blokere markedsadgangen.

- Overgangsmærkning
Revisorer kan acceptere midlertidig mærkning af tidlige produktioner, hvis det endelige artwork er godkendt og planlagt. Stærke OEM'er håndhæver batchadskillelse og forhindrer ikke-endelige etiketter i at komme ind i detailhandlen.
- Iscenesat dokumentation under opskalering
Revisorer kan acceptere midlertidig mærkning af tidlige produktioner, hvis det endelige artwork er godkendt og planlagt. Stærke OEM'er håndhæver batchadskillelse og forhindrer ikke-endelige etiketter i at komme ind i detailhandlen.
- Parallel testning under pilotkørsler
Stærke OEM'er udfører stabilitets-, mikrobielle og emballagetests under pilotbatcher, hvilket reducerer lanceringstiderne med uger eller måneder.
Visuel pladsholder #1: Hierarki for revisionskrav (Mundplejeprodukter)
| Revisionsprioritetsniveau | Kravkategori | Hvad dette inkluderer | Revisionspåvirkning, hvis manglende |
| Niveau 1 — Ikke-forhandlingsbart | Produktklassificering | Bestemmelse af kosmetisk vs. håndkøbs-/kvasilægemiddel, tærskler for aktive ingredienser | Øjeblikkelig revisionsfejl eller toldtilbageholdelse |
| GMP og facilitetstatus | ISO 22716, FDA-registrering, hygiejnekontroller | Forsendelsesafvisning, fabriksdiskvalifikation | |
| Batchsporbarhed | Batchregistreringer, tilbagekaldelsesparathed, lotkodning | Obligatorisk korrigerende handling, potentiel tilbagekaldelse | |
| Niveau 2 — Betinget påkrævet | Stabilitetsstøtte | Accelereret og/eller realtidsstabilitet knyttet til holdbarhed | Betinget godkendelse, forpligtelse efter markedsføring |
| Underbyggelse af påstand | Data, der understøtter påstande om hvidtning, fluorid, plak og CPC | Fjernelse eller ommærkning af krav kræves | |
| Overholdelse af lokale mærkningsregler | Sprog, format, navngivningskonventioner for ingredienser | Omkostninger ved ommærkning, lanceringsforsinkelse | |
| Niveau 3 — Kan forhandles (OEM-afhængig) | Overgangsmærkning | Midlertidig illustration med godkendte endelige versioner arkiveret | Accepteret med dokumenteret solnedgangsplan |
| Iscenesat dokumentation | Udskudte langtidstests under opskalering | Accepteret hvis risikovurderet og planlagt | |
| Parallel testning | Stabilitets- og mikrobielle tests under pilotforsøg | Accepteret med stærke batchkontroller |
OEM-hentning:
Brands dumper revisioner ved at behandle niveau 2- og niveau 3-punkter som valgfri gætværk i stedet for risikostyring. En stærk OEM styrer dette hierarki proaktivt.
Mundpleje – specifikke revisionspunkter Brands Miss
De fleste fejl i mundhygiejneaudits skyldes ikke manglende certifikater. De opstår, når brands anvender generelle kosmetiske antagelser på produkter med højere risiko med aktive ingredienser, funktionelle påstande og daglig brug.

Revisorer fokuserer tidligt på disse mundplejespecifikke detaljer, og mangler fører ofte til forsinkelser, ommærkning eller korrigerende handlinger.
Tandpastaspecifikke revisionspunkter
Tandpasta revideres mere aggressivt på grund af påstande om aktiv og terapeutisk brug.
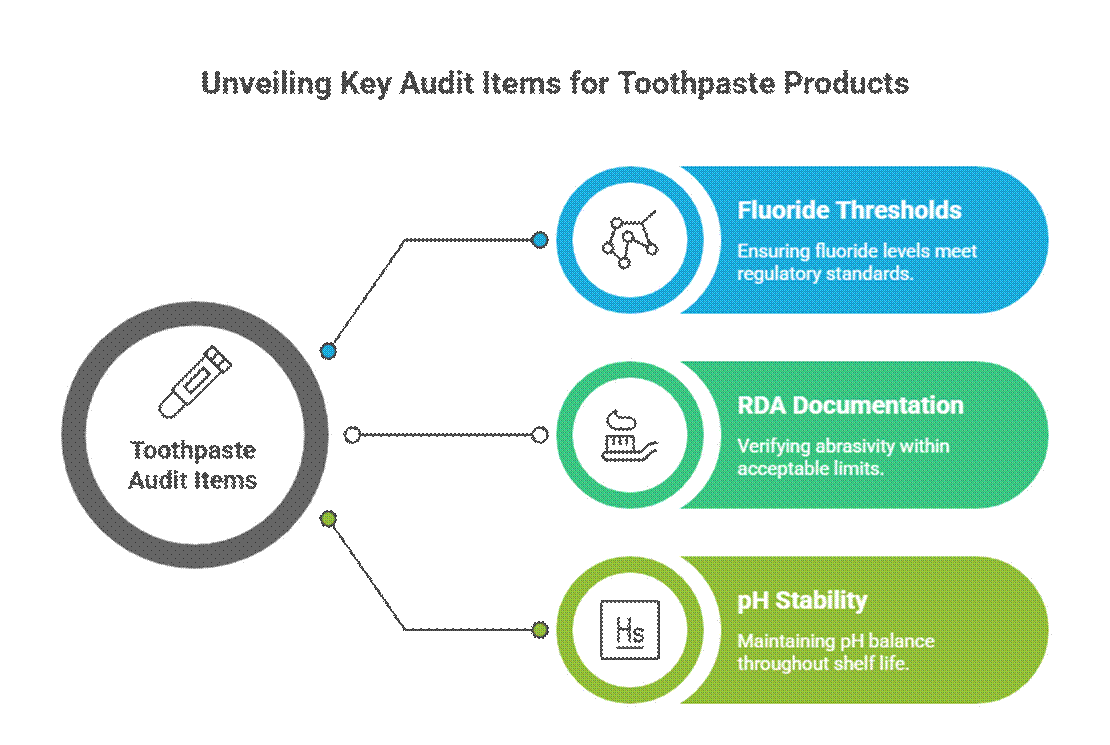
- Fluoridtærskler (relevans for FDA-monografi)
I USA, fluor tandpasta skal overholde FDA-monografien for fluortandpasta, herunder aktiv koncentration, mærkningsformat og overensstemmelse med påstande. Revisorer forventer også RDA-dokumentation for tandpasta og validerede krav til stabilitetstest for mundpleje i hele holdbarheden.
- RDA-dokumentation (slidgrænser)
Auditorer forventer, at data om relativ dentinslibningsevne (RDA) bekræfter emaljens sikkerhed. Manglende eller for høje RDA-værdier er et almindeligt rødt flag, især for blegning eller kulformuleringer.
- pH-stabilitet over hele holdbarheden
Tandpastaens pH-værdi skal forblive inden for et sikkert, funktionelt område i hele dens holdbarhed. Auditorer gennemgår stabilitetsdata for at sikre, at pH-forskydning ikke kompromitterer fluorids effektivitet eller orale sikkerhed.
Mundskyllemiddelspecifikke revisionspunkter
Overholdelsesaudit for mundskyllemiddel fokus på mikrobiel kontrol og aktiv koncentration, især for formler, der kræver dokumentation for overholdelse af CPC-mundskyllemiddel og test af konserveringsmiddeleffektivitet.
- Klassifikationer af alkoholfri vs. alkoholholdig
Tandpasta revideres mere aggressivt på grund af påstande om aktiv og terapeutisk brug.
- CPC %-dokumentation
Revisorer kontrollerer koncentrationsgrænser og overensstemmelse med krav for CPC-holdige formler.
- Rapporter om mikrobielle provokationstests
Manglende eller forældede udfordringstests fører ofte til betingede godkendelser.
- Test af konserveringsmiddeleffektivitet
Svage konserveringssystemer behandles som produktsikkerhedsrisici.
Røde flag for blegemidler
Revisorer undersøger nøje påstande om regulering af hvidtende tandpasta, især sprog, der antyder emaljemodifikation, permanent hvidtning eller terapeutiske resultater, der kan udløse tilsyn på lægemiddelniveau.

- Påstande om blegning vs. påstande om lægemidler (USA)
Påstande, der antyder ændring af emalje eller terapeutiske resultater, kan udløse lægemiddelklassificering.
- Oplysning om peroxid/ikke-peroxid
Revisorer kræver klar oplysning om hvidtningsaktive stoffer og koncentrationer.
- Kravformulering, der udløser lovgivningsmæssig gennemgang
Revisorer kræver klar oplysning om hvidtningsaktive stoffer og koncentrationer.
OEM-hentning:
Mundplejerevisioner fejler på aktive ingredienser og påstande, ikke på emballagens æstetik.
Opfordring til handling midt i artiklen #1: Download eksempelpakke til overholdelse af regler
Gennemgå anonymiseret, revisionsklar OEM-dokumentation, før du forpligter dig til MOQ eller færdiggør en markedslancering.
Regionale revisionsrammer (udførelsesfokuseret)
Revisioner varierer fra region til region, men logikken er ensartet: Regulatorer vurderer produktrisiko først, dokumentation derefter og mærkning til sidst. Det, der er forskelligt, er, hvor håndhævelsen finder sted.
USA — FDA og MoCRA
Amerikansk håndhævelse fokuserer i stigende grad på FDA's krav til mundplejerevision, hvor Overholdelse af MoCRA-regler for mundpleje udvidet ansvarlighed efter markedet for mærker inden for mundpleje.
- Kosmetisk vs. håndkøbsbehandlingstræ
Fejlklassificering er en almindelig udløser for håndhævelse.
- Registrering af faciliteter og produktliste
Revisorer verificerer MoCRA-registreringens nøjagtighed og SKU-overensstemmelse.
- Batchregistreringer og beredskab mod bivirkninger
Mærker skal demonstrere sporbarheds- og klagehåndteringssystemer.
- Hvidningspåstande: hvor mærker går over grænsen
Overdrevne påstande om hvidtning udløser ofte lægemiddelundersøgelser.
Den Europæiske Union — CPNP og PIF
Overholdelse af EU's regler for mundpleje via CPNP og PIF kræver fuld overensstemmelse mellem formulering, mærkning og CPSR-krav for mundplejeprodukter, hvor ansvaret ligger hos den ansvarlige person.

- Rollen som ansvarlig person (RP)
Den ansvarlige person skal kontrollere og have adgang til hele produktinformationsfilen.
- Forventninger til sikkerhedsvurdering
Generiske CPSR'er afvises ofte til mundplejeprodukter.
- Stabilitets-, CPSR- og mærkningskontroller
Uoverensstemmelser på tværs af dokumenter er almindelige fejlpunkter.
- Importøransvarsrisiko
Ansvaret ligger hos RP'en eller importøren, ikke OEM'en.
Mellemøsten — GSO 1943
GSO 1943 registrering i mundpleje lægger pres på håndhævelsen af toldmyndighederne, hvilket gør nøjagtighed i mærkningen og ensartethed i indsendelser afgørende for klarering af forsendelser.
- Tidsfrister for produktregistrering
Ufuldstændige indsendelser nulstiller ofte processen.
- Krav til arabisk mærkning
Manglende eller forkerte arabiske underetiketter forårsager ofte forsendelsestilbageholdelser.
- Almindelige årsager til toldbeslaglæggelse
Ændringer af etiketter efter indsendelse og uoverensstemmelser i dokumentation.
Mikrosag: EU-toldtilbageholdelse forårsaget af dokumentationsforskydning
En europæisk distributør importerede en fluoridblegningstandpasta produceret af en lavkvalitets-OEM. Selvom selve formuleringen var i overensstemmelse med kravene, blev forsendelsen stoppet ved tolden på grund af uoverensstemmelser mellem produktinformationsfilen (PIF), stabilitetsdata og de endelige etikettepåstande. CPSR refererede til en tidligere formuleringsversion; realtidsstabilitet var ikke blevet iværksat, og blegningspåstandene oversteg, hvad sikkerhedsvurdereren havde godkendt.
Resultatet var en fire ugers toldstop, obligatorisk ommærkning og 11.800 euro i uplanlagte omkostninger – mens lagerkapitalen stod ubrugt. Hvis formuleringsversioner, stabilitetsprotokoller og dokumentation af påstande havde været låst inden indsendelse, ville forsendelsen være blevet klaret uden indgriben.
Derfor udfører erfarne OEM'er inden for mundpleje parallelle stabilitetstest, fryser formuleringsversioner inden færdiggørelse af PIF og udfører risikovurderinger af krav inden godkendelse af artwork – hvilket forhindrer dokumentationsforskydninger, som revisorer straks markerer.
Ansvarsafklaring
Stærk overholdelse af GMP-standarden for mundplejeprodukter, understøttet af ISO 22716-produktion af mundplejeprodukter, sikrer, at revisorer kan verificere sporbarhedskravene for mundplejebatcher uden korrigerende handlinger eller tilbagekaldelser.
Hos Oralabx støtter vi brands ved klart at adskille juridisk ansvar fra udførelsesstøtte – vi leverer batchspecifik, revisionsklar dokumentation, samtidig med at vi markerer klassificerings- og kravrisici, før de bliver håndhævelsesproblemer.
Importør vs. OEM-ansvar (afsnit om klarhed)
En klar ansvarsdeling er afgørende for at bestå mundhygiejneaudits og undgå ansvar efter markedsføring. Tilsynsmyndighederne vurderer ikke "hensigt" eller uformelle forståelser – de vurderer, hvem der er juridisk ansvarlig, og hvem der kontrollerer dokumenterne. Når rollerne er uklare, overlades håndhævelsen som standard til importøren, selvom OEM'en udførte de fleste compliance-opgaver.
Hvad importøren er juridisk ansvarlig for
Uanset OEM-støtte tildeler tilsynsmyndighederne det endelige ansvar til den part, der bringer produktet på markedet. Importører kan ikke outsource disse forpligtelser uden eksplicit juridisk omplacering.

- Markedstilladelse
Sikring af juridisk godkendelse før salg.
- Godkendelse af krav
Alle markedsførings- og emballagepåstande falder ind under importørens ansvar.
- Opbevaring af detailhandelsdokumentation
Importører skal opbevare og fremvise overensstemmelsesdokumenter efter anmodning, herunder adgang til PIF, COA'er, SDS og batchsporbarhedsregistre.
Hvad en kompetent OEM skal levere
En kvalificeret OEM inden for mundpleje understøtter overholdelse af regler ved at levere verificerbar, revisionsklar dokumentation, der er direkte knyttet til hver produktionsbatch.
- GMP-certificering
Strøm, regionsanerkendt GMP-certificering (f.eks. ISO 22716) der demonstrerer kontrollerede produktions-, hygiejne- og kvalitetssystemer.
- Batchregistreringer og sporbarhed
Komplet produktionsregistrering, lotkodning og sporbarhed for tilbagekaldelser, der forbinder råvarer, produktionskørsler og færdigvarer.
- CoA, SDS, stabilitets- og mikrobielle rapporter
Batchspecifikke analysecertifikater, sikkerhedsdatablade, stabilitetsstudier og mikrobielle/provokationstestrapporter i overensstemmelse med den endelige formulering.
- Eksportér dokumentation
Nøjagtige handelsfakturaer, pakkelister, erklæringer og støttende eksportdokumenter, der er i overensstemmelse med registrerede produktdata og mærkning.
Visuel pladsholder #2: Tabel over importør- vs. OEM-ansvar
Denne tabel tydeliggør, hvordan tilsynsmyndigheder fordeler ansvar under mundplejerevisioner, og hvor OEM-support slutter, og det juridiske ansvar begynder.
Importør vs. OEM-ansvar (overholdelse af mundplejeregler)
| Overholdelsesområde | Importør (juridisk ansvar) | OEM (Udførelsesstøtte) |
| Produktklassificering | Endelig klassificeringsbeslutning | Formuleringsinput og risikomarkeringer |
| Markedstilladelse | Registrering, underretning, RP-aftale | Data- og dokumentforberedelse |
| Godkendelse af krav | Påstandens lovlighed og dokumentation | Risikovurdering af skader og dataunderstøttelse |
| GMP-overholdelse | Bekræfter OEM-kvalifikation | Vedligeholder GMP-systemer og audits |
| Batchsporbarhed | Opbevarer og producerer optegnelser | Opretter batchregistreringer og lotkodning |
| Stabilitets- og sikkerhedsdata | Sikrer tilstrækkelighed for markedet | Udfører tests og rapporterer om problemer |
| Overholdelse af mærkningsregler | Endelig godkendelse af etiketten | Gennemgang af kunstværker og formatvejledning |
| Revisionsberedskab for detailhandlere | Dokumentopbevaring | Dokumentlevering og opdateringer |
| Håndhævelse og tilbagekaldelser | Finansielt og juridisk ansvar | Teknisk undersøgelsesstøtte |
Vigtig afklaring:
OEM'er muliggør overholdelse af regler, men importører bærer den lovgivningsmæssige risiko, medmindre ansvaret kontraktligt omfordeles. Denne sondring er central for revisionsresultater og eksponering efter markedet.
Hvad en GOD OEM rent faktisk gør under en revision
På RUIQIGO, audits behandles ikke som dokumentationshændelser. Vores OEM-teams designer produktionssystemer omkring lovgivningsmæssige kontrolpunkter fra dag ét – og integrerer batchsporbarhed, aktiv kontrol og overholdelsesverifikation direkte i den daglige produktion.
OEM-compliance-workflow (faktisk udførelse)
Under en revision demonstrerer kompetente OEM'er overholdelse af reglerne gennem proceskontrol, ikke reaktivt papirarbejde. Revisorer vurderer, om systemer er integreret i den daglige produktionsdrift.
- Validering af benchformulering
Formuleringer valideres på bænkeskala for at bekræfte aktive koncentrationer, pH-område og ingredienskompatibilitet før opskalering.
- Accelereret + stabilitet i realtid
Accelereret stabilitet understøtter tidlige indsendelser, mens realtidsstudier kører parallelt for at validere holdbarheden og detektere formuleringsforskydninger.
- Oprettelse af batchark
Hver produktionskørsel understøttes af batchark, der dokumenterer råmaterialer, procesparametre, proceskontroller og lotkoder.
- Mikrobiel og kemisk testning
Færdigvarer gennemgår mikrobiel testning og kemisk verifikation for at bekræfte sikkerhed, konserveringsmiddelegenskaber og overholdelse af aktive ingredienser.
- Udstedelse af certifikat
Batchspecifikke analysecertifikater udstedes og krydstjekkes med specifikationerne inden frigivelse.
- Eksport- og tolddokumentation
Forsendelsesdokumenter, erklæringer og overholdelsesfiler er afstemt med registrerede produktdata for at forhindre uoverensstemmelser i toldmyndighederne.
Hvordan lavprisproducenter fejler
Revisionsfejl kan ofte spores tilbage til systemiske svagheder snarere end isolerede fejl. Lavprisproducenter mangler typisk compliance-infrastruktur og reagerer kun, når problemer opstår.
- Manglende batchsporbarhed
Utilstrækkelige eller inkonsistente batchregistreringer forhindrer effektive tilbagekaldelser og underminerer øjeblikkeligt revisorernes tillid.
- Genbrug af generisk sikkerhedsdatablad
Genbrugte eller ikke-batchspecifikke sikkerhedsdatablade signalerer dårlig formuleringskontrol og markeres ofte under revisioner.
- Ingen gennemgang af skadesrisiko
Producenter, der ikke vurderer de lovgivningsmæssige risici knyttet til markedsføringsanprisninger, udsætter mærker for fejlklassificering og håndhævelsesforanstaltninger.
- Reaktiv (ikke proaktiv) compliance
Overholdelse af regler og regler behandles som en dokumentanmodning i sidste øjeblik snarere end et integreret produktionssystem, hvilket fører til forsinkelser, korrigerende handlinger og mislykkede revisioner.
OEM takeaway-boks:
Manglende overholdelse af regler er produktionsfejl, ikke papirarbejde. Revisorer straffer svage systemer, ikke manglende filer.
Midt i artikel CTA #2: Anmod om RP / MoCRA-konsultationsopkald
Afklar importørens ansvar, produktklassificeringsrisici og dokumentationsmangler med en compliance-specialist inden indsendelse eller forsendelse af regulatoriske krav.
Visualiseret tidslinje for revision (valgfrit, men stærkt)
Tidsfristerne for revisioner varierer fra region til region, men forsinkelser opstår konsekvent på de samme udførelsespunkter – klassificeringsbeslutninger, ufuldstændig dokumentation og mærkningsrettelser i sen fase. Forståelse af, hvor tid rent faktisk går tabt, giver brands mulighed for at planlægge lanceringer realistisk og undgå lagerstop.

Visuel pladsholder #3: Tidslinjediagram for revision (USA vs. EU vs. Mellemøsten)
Sammenligning af tidslinje for mundplejerevision
| Revisionsfasen | USA (FDA / MoCRA) | Den Europæiske Union (CPNP / PIF) | Mellemøsten (GSO 1943) |
| Produktklassificering | Kosmetisk vs. håndkøbsbehandling | Kosmetisk klassificering | Kosmetisk klassificering |
| Facilitet / OEM-kvalifikation | Registrering af faciliteter | OEM-kvalificering via RP | OEM-datagennemgang |
| Sikkerheds- og stabilitetsgennemgang | Begrænset præmarked | CPSR + stabilitetsgennemgang | Stabilitetsgennemgang |
| Gennemgang af påstande og mærkning | Moderat | Streng, præmarkedsført | Streng, præmarkedsført |
| Registrering/anmeldelse | Produktliste | CPNP-meddelelse | Produktregistrering |
| Told og klarering | Håndhævelse efter markedsføring | Minimal ved grænsen | Høj håndhævelse |
| Markedsadgang | Tidlig adgang tilladt | Indtastning efter godkendelse | Indtastning efter godkendelse |
| Håndhævelse efter markedsføring | Høj | Moderat | Lav-moderat |
OEM-hentning:
Time-to-market komprimeres af parallelle compliance-workflows, ikke ved at springe trin over.
Konklusion (Kommerciel afslutning)
Langsigtet succes inden for mundpleje afhænger af strukturerede systemer, ikke reaktivt papirarbejde. Mærker, der behandler revisioner og overholdelse af mundplejeprodukter som en produktionsdisciplin, ikke en indsendelsesopgave, beskytter marginer, tidslinjer og detailhandlernes tillid. For mærker, der skalerer tandpasta, mundskyl eller hvidtningsprodukters SKU'er, fungerer Oralabx som en compliance-eksekveringspartner – og tilpasser formulering, dokumentation og batchsystemer til revisionsrealiteter i USA, EU og Mellemøsten, så lovgivningsmæssig godkendelse omdannes til forudsigelig markedsadgang.
Ofte stillede spørgsmål
Q1. Hvem er juridisk ansvarlig, hvis en mundhygiejneaudit mislykkes – importør eller OEM?
Importøren er juridisk ansvarlig som standard. OEM'er kan understøtte overholdelse af regler, men ansvaret ændres kun, hvis det eksplicit omfordeles ved kontrakt og accepteres af tilsynsmyndighederne.
Q2. Kræver SKU'er for mundskyl med enkeltpose fuld dokumentation for overholdelse af reglerne?
Ja. Poseformater er ikke undtaget. Auditorer vurderer formulering, påstande og sikkerhedsdata uanset pakningsstørrelse.
Q3. Kan mundskylleprøver i enkeltposer sendes uden sikkerhedsdatablad eller ægthedscertifikat?
I de fleste tilfælde nej. Prøver kan transporteres under begrænsede undtagelser, men sikkerhedsdatablade og ægthedsbeviser er ofte påkrævet ved tolden, især for flydende mundplejeprodukter.
Q4. Hvor længe før lanceringen bør compliance-arbejdet påbegyndes?
Ideelt set 3-6 måneder før lancering. Produkter med aktive ingredienser eller hvidtningspåstande bør starte compliance-planlægning endnu tidligere.
Q5. Kræver Amazon-lister ægthedsbevis eller sikkerhedsdatablad?
Amazon anmoder ofte om certifikater (CoA'er), sikkerhedsdatablade (SDS) og overholdelsesdokumenter under godkendelse af børsnotering eller revisioner efter børsnotering, især for mundplejeprodukter.
Q6. Hvilke dokumenter skal opbevares hos detailhandleren?
Detailhandlere kræver typisk adgang til COA'er, SDS'er, batchsporbarhedsregistre og bevis for markedsføringstilladelse efter anmodning.
Q7. Tæller påstande om hvidtning som påstande om lægemidler i USA?
Det kan de. Påstande om permanent hvidtning, ændring af emalje eller terapeutiske virkninger udløser ofte granskning på lægemiddelniveau.
Q8. Kan en ansvarlig person i EU også håndtere GCC-markeder?
Nej. GCC-markeder kræver separate lokale registrerings- og overholdelsesprocesser; en EU RP dækker ikke automatisk lovgivningsmæssige forpligtelser i Mellemøsten.
Endelig opfordring til handling: Overholdelsestjekliste PDF
Undgå forsinkelser i revisioner, omkostninger til ommærkning og toldtilbageholdelser.
Download vores tjekliste for overholdelse af mundpleje i PDF-format, eller tal direkte med en OEM-compliancespecialist at validere din dokumentation inden lancering.







