Johdanto
Tämä opas on kirjoitettu hankintapäälliköille, brändien perustajille ja vaatimustenmukaisuudesta vastaaville päälliköille, jotka hankkivat hammastahnaa, suuvettä ja valkaisutuotteita ja ovat vastuussa suunhoitotuotteiden hyväksynnästä ja hyllyille pääsystä. Suunhoitotuotteiden auditoinnit ja vaatimustenmukaisuus ovat lanseerausten viivästysten, tullipidätysten, uudelleenmerkintäkustannusten ja epäonnistuneen vähittäiskaupan perehdytyksen pääasiallisia syitä – eivät niinkään koostumuksen laatu.

Suunhoito kasvot tiukempi valvonta kuin yleiskosmetiikassa vaikuttavien aineiden, tuotevaatimusten ja erän jäljitettävyyden vuoksi, ja neljän viikon tullipysäys voi vangita kuusinumeroisia määriä käteistä. Tässä artikkelissa eritellään alueittain auditointilogiikka, suuhygieniakohtaiset vaatimukset sekä selkeät OEM- ja maahantuojan vastuut.
Klo Oralabx, työskentelemme brändien kanssa erityisesti tässä vikapisteessä – jossa koostumus voi olla valmis, mutta vaatimustenmukaisuuden toteutus ratkaisee, pääseekö tuote todella markkinoille.
Miten suun terveydenhuollon tarkastukset todellisuudessa toimivat (pakollinen vs. valinnainen)
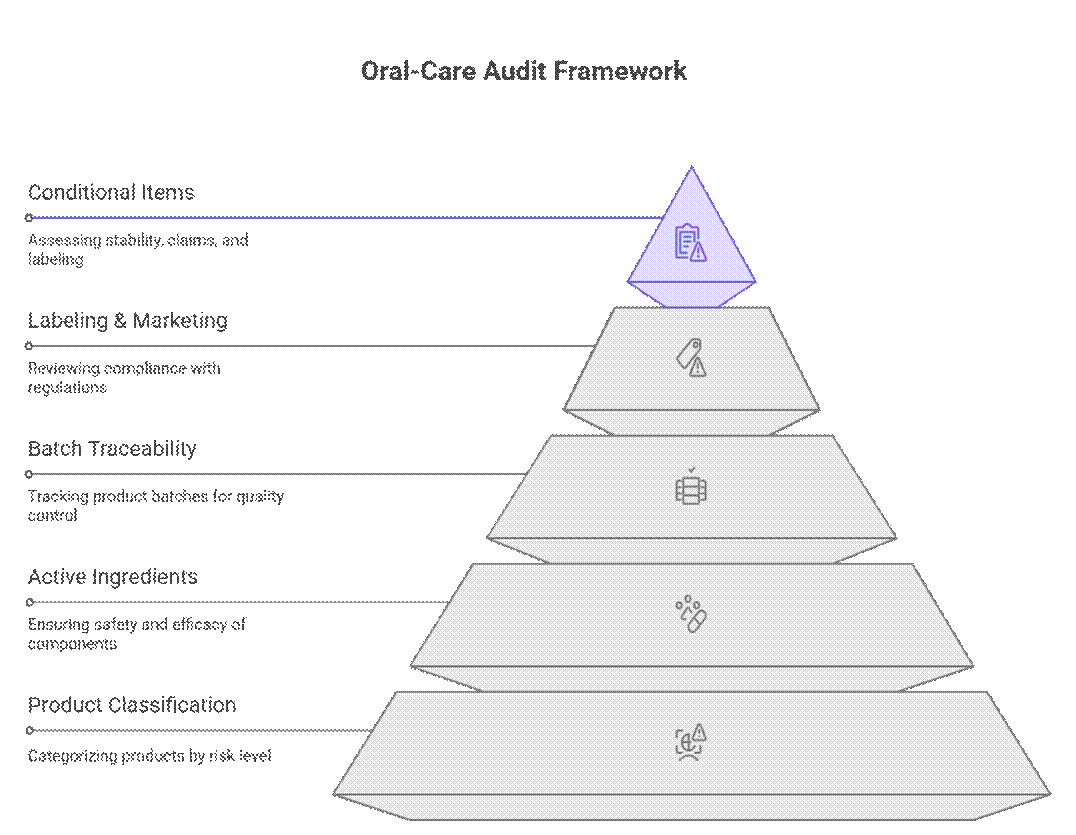
Sääntelyviranomaiset lähestyvät suuhygieniatuotteiden auditointeja ja vaatimustenmukaisuutta porrastetulla, riskiperusteisella kehyksellä, joka priorisoi tuoteluokituksen, vaikuttavat ainesosat ja erän jäljitettävyyden ennen merkintöjä tai markkinoille saattamista. Vasta näiden läpäisyn jälkeen he tarkastelevat ehdollisia kohtia, kuten säilyvyyden kestoa, väitteiden perusteluja tai siirtymävaiheen merkintöjä.
Mitä tilintarkastajat tarkistavat ensin (ei neuvoteltavissa)
Tilintarkastajat aloittavat tiukoilla vaatimuksilla, jotka on täytettävä ennen kuin jatkotarkastukset voivat jatkua.
- Tuoteluokitus (kosmeettinen vs. reseptivapaa / lähes lääke)
Väärä luokittelu on edelleen yksi yleisimmistä hammastahnojen auditointivaatimusten puutteista, erityisesti silloin, kun tuotemerkit ymmärtävät väärin suunhoitotuotteiden luokittelun kosmeettisten ja käsikauppalääkkeiden välillä, jotka liittyvät vaikuttaviin aineosiin ja väitteisiin.
- Vaikuttavien aineiden kynnysarvot
Varmistaa ainesosien, kuten fluoridin tai CPC:n, raja-arvojen noudattamisen, mikä voi johtaa käsikauppalääkkeiden tai lääketason valvontaan.
- Valmistajan rekisteröinti ja GMP-status
Varmistaa, että OEM-laitos on asianmukaisesti rekisteröity ja toimii hyväksyttyjen GMP-standardien mukaisesti suuhygieniatuotteiden tuotanto.
- Erän jäljitettävyys ja takaisinvetovalmius
Varmistaa, että täydelliset erätiedot ovat olemassa, jotta tuotteet voidaan jäljittää, eristää ja vetää takaisin nopeasti, jos sääntelyviranomaiset tai jälleenmyyjät sitä edellyttävät.
Mikä on ehdollisesti pakollinen
Kiinteän osan lisäksi tilintarkastajat soveltavat riskiperusteista tarkastusta dokumentaatioon ja testaukseen. Täytäntöönpano vaihtelee markkina- ja tuoteriskin mukaan, mutta puutteet johtavat usein viivästyksiin tai ehdollisiin hyväksyntöihin.
- Vakauden kesto (nopeutettu vs. reaaliaikainen)
Nopeutettu vakaus voi riittää varhaisiin tai vähäriskisiin lanseerauksiin, mutta reaaliaikaista vakautta tarvitaan usein tuotteille, joissa on vaikuttavia aineita, pidempi säilyvyysaika tai tiukemmat markkina-alueet, kuten EU tai GCC. Vahvat laitevalmistajat käyttävät reaaliaikaista vakautta rinnakkain.
- Väitteen perustelun syvyys
Peruskosmeettiset väitteet vaativat yleensä vain vähän perusteluja, kun taas suorituskykyväitteet tarvitsevat laboratorio- tai kliinisiä tietoja. Auditoijat merkitsevät väitteet, joista puuttuu näyttöä tai jotka eivät vastaa lopullista koostumusta.
- Paikallinen kieli ja merkintämuodot
Englanninkieliset etiketit saattavat toimia tarkistuksessa, mutta lopullinen hyväksyntä edellyttää yleensä paikalliskielisten pakkausmerkintöjen vaatimustenmukaisuutta. Auditoijat merkitsevät usein puuttuvia alaetikettejä, virheellisiä ainesosien nimiä tai riskialttiita väitteiden käännöksiä.
Mikä on neuvoteltavissa (vahvan OEM-valmistajan kanssa)
Vaikka määräykset vaikuttavat jäykiltä, kokeneet auditoijat tunnistavat käytännön valmistuksen realiteetit. Todistetun laitevalmistajan ja selkeän vaatimustenmukaisuutta koskevan etenemissuunnitelman avulla jotkin vaatimukset voidaan vaiheistaa tai jaksottaa estämättä markkinoille pääsyä.

- Siirtymäkauden merkinnät
Tilintarkastajat voivat hyväksyä väliaikaiset etiketit varhaisille erille, jos lopullinen kuvamateriaali on hyväksytty ja aikataulutettu. Vahvat laitevalmistajat valvovat erien erottelua ja estävät muiden kuin lopullisten etikettien pääsyn vähittäiskauppaan.
- Vaiheittainen dokumentointi skaalauksen aikana
Tilintarkastajat voivat hyväksyä väliaikaiset etiketit varhaisille erille, jos lopullinen kuvamateriaali on hyväksytty ja aikataulutettu. Vahvat laitevalmistajat valvovat erien erottelua ja estävät muiden kuin lopullisten etikettien pääsyn vähittäiskauppaan.
- Rinnakkaistestaus pilottiajojen aikana
Vahvat laitevalmistajat suorittavat stabiilius-, mikrobi- ja pakkaustestejä pilottierien aikana, mikä lyhentää lanseerausaikatauluja viikkojen tai kuukausien verran.
Visuaalinen paikkamerkki #1: Auditointivaatimusten hierarkia (suunhoitotuotteet)
| Tarkastuksen prioriteettitaso | Vaatimusluokka | Mitä tämä sisältää | Tarkastuksen vaikutus puuttuessa |
| Taso 1 — Ei neuvoteltavissa | Tuoteluokitus | Kosmeettinen vs. OTC / kvasi-lääkemääritys, vaikuttavien aineiden kynnysarvot | Välitön tarkastusvirhe tai tullipidätys |
| GMP- ja laitostila | ISO 22716, FDA-rekisteröinti, hygieniavalvonta | Lähetyksen hylkääminen, tehtaan hylkääminen | |
| Erän jäljitettävyys | Erätietueet, takaisinvetovalmius, eräkoodaus | Pakollinen korjaava toimenpide, mahdollinen takaisinveto | |
| Taso 2 – Ehdollisesti pakollinen | Vakautustuki | Nopeutettu ja/tai reaaliaikainen vakaus sidottu säilyvyysaikaan | Ehdollinen hyväksyntä, markkinoille saattamisen jälkeinen velvoite |
| Väitteen perustelu | Valkaisua, fluoria, plakkia ja CPC-väitteitä tukevat tiedot | Vaatimuksen poistaminen tai uudelleennimeäminen vaaditaan | |
| Paikallisten merkintöjen noudattaminen | Kieli, muoto, ainesosien nimeämiskäytännöt | Uudelleenmerkintäkustannukset, lanseerauksen viivästyminen | |
| Taso 3 — Neuvoteltavissa (OEM-valmistajasta riippuvainen) | Siirtymäkauden merkinnät | Väliaikainen taideteos, josta on tallennettu hyväksytyt lopulliset versiot | Hyväksytty dokumentoidulla päättymissuunnitelmalla |
| Vaiheittainen dokumentaatio | Lykätyt pitkäaikaistestit skaalauksen aikana | Hyväksytään, jos riskiarvioitu ja aikataulutettu | |
| Rinnakkaistestaus | Stabiilisuus- ja mikrobitestit pilottiajojen aikana | Hyväksytty vahvoilla eräkontrollimenetelmillä |
OEM-yhteenveto:
Brändit epäonnistuvat auditoinneissa käsittelemällä tason 2 ja tason 3 kohteita valinnaisina arvauksina riskinhallinnan sijaan. Vahva laitevalmistaja (OEM) hallitsee tätä hierarkiaa ennakoivasti.
Suunhoitoon liittyvät tarkastuskohteet Tuotemerkit Miss
Useimmat suunhoidon auditointien epäonnistumiset eivät johdu puuttuvista sertifikaateista. Ne tapahtuvat, kun tuotemerkit soveltavat yleisiä kosmeettisia oletuksia korkeamman riskin tuotteisiin, joissa on vaikuttavia aineita, toiminnallisia väitteitä ja joita käytetään päivittäin.

Auditoijat keskittyvät näihin suunhoitoon liittyviin yksityiskohtiin jo varhaisessa vaiheessa, ja puutteet johtavat usein viivästyksiin, uudelleenmerkintöihin tai korjaaviin toimenpiteisiin.
Hammastahnakohtaiset auditointikohteet
Hammastahnaa auditoidaan aggressiivisemmin aktiivisten ja terapeuttisten väitteiden vuoksi.
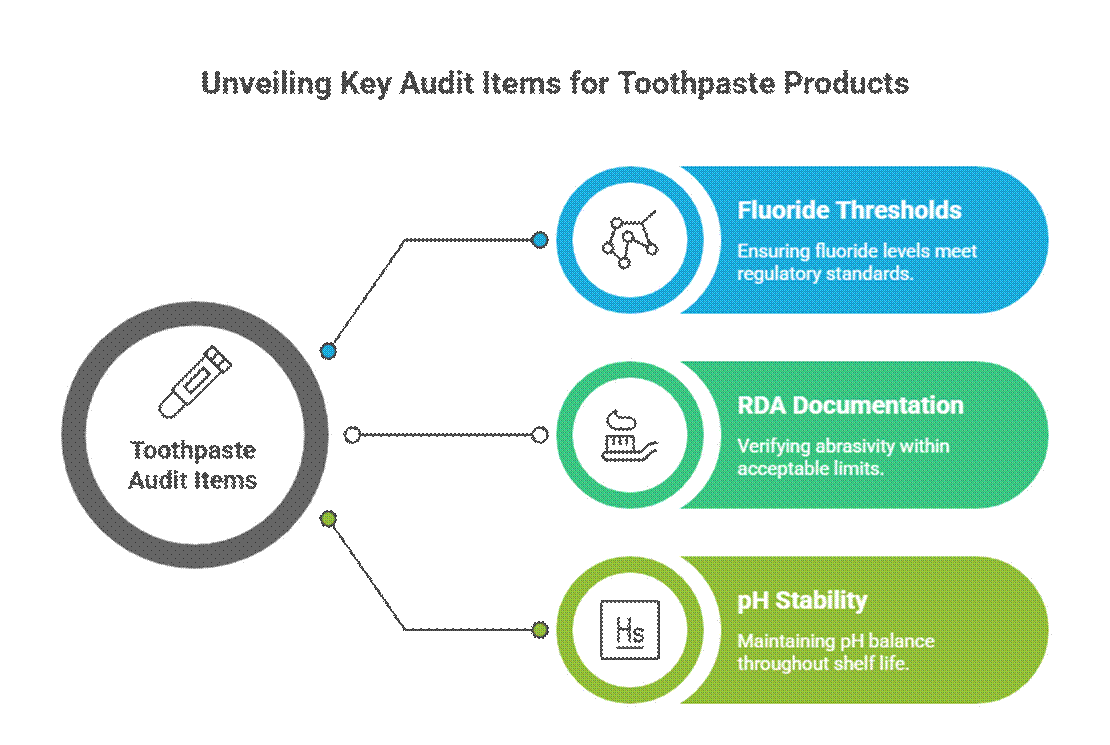
- Fluorikynnysarvot (FDA:n monografian kannalta merkitykselliset)
Yhdysvalloissa, fluorihammastahna on noudatettava fluorihammastahnojen FDA:n monografiaa, mukaan lukien vaikuttavan aineen pitoisuus, pakkausmerkintöjen muoto ja väitteiden yhdenmukaisuus. Auditoijat odottavat myös hammastahnan RDA-dokumentaatiota ja validoituja suunhoidon stabiiliustestausvaatimuksia koko säilyvyysajan ajan.
- RDA-dokumentaatio (kulumisrajat)
Auditoijat odottavat suhteellisen dentiinin hankauskyvyn (RDA) vahvistavan kiilteen turvallisuuden. Puuttuvat tai liian korkeat RDA-arvot ovat yleinen varoitusmerkki, erityisesti valkaisu- tai aktiivihiiliformulaatioiden kohdalla.
- pH-stabiilius säilyvyysajan aikana
Hammastahnan pH-arvon on pysyttävä turvallisella ja toimivalla alueella koko säilyvyysajan. Auditoijat tarkistavat stabiiliustiedot varmistaakseen, että pH-arvon vaihtelu ei vaaranna fluoridin tehoa tai suun turvallisuutta.
Suuvesikohtaiset auditointikohteet
Suuvesien vaatimustenmukaisuustarkastukset keskittyvät voimakkaasti mikrobien torjuntaan ja vaikuttavan aineen pitoisuuteen, erityisesti koostumuksissa, jotka edellyttävät CPC-suuvesien vaatimustenmukaisuusdokumentaatiota ja säilöntäaineiden tehokkuuden testausta.
- Alkoholittomien ja alkoholia sisältävien tuotteiden luokitukset
Hammastahnaa auditoidaan aggressiivisemmin aktiivisten ja terapeuttisten väitteiden vuoksi.
- CPC % -dokumentaatio
Tilintarkastajat tarkistavat pitoisuusrajat ja väittävät yhdenmukaisuutta CPC:tä sisältävien kaavojen kanssa.
- Mikrobialtistustestien raportit
Puuttuvat tai vanhentuneet haastetestit johtavat usein ehdollisiin hyväksyntöihin.
- Säilöntäaineiden tehokkuuden testaus
Heikkoja säilöntäjärjestelmiä käsitellään tuoteturvallisuusriskeinä.
Valkaisevien tuotteiden varoitusmerkit
Tilintarkastajat tutkivat tarkasti valkaisevia hammastahnoja koskevia sääntelyväitteitä, erityisesti kieltä, joka viittaa hammaskiilteen muokkaamiseen, pysyvään valkaisuun tai terapeuttisiin tuloksiin, jotka voivat johtaa lääketason valvontaan.

- Valkaisevia väitteitä vs. lääkeväitteitä (Yhdysvallat)
Väitteet, jotka viittaavat hammaskiilteen muuttumiseen tai terapeuttisiin tuloksiin, voivat johtaa lääkkeen luokitteluun.
- Peroksidin / ei-peroksidin paljastaminen
Tilintarkastajat vaativat valkaisevien aktiiviaineiden ja pitoisuuksien selkeää selvitystä.
- Väitteen sanamuoto, joka käynnistää sääntelytarkastuksen
Tilintarkastajat vaativat valkaisevien aktiiviaineiden ja pitoisuuksien selkeää selvitystä.
OEM-yhteenveto:
Suunhoidon auditoinnit epäonnistuvat vaikuttavien aineiden ja väitteiden, eivät pakkausten estetiikan, osalta.
Artikkelin puolivälissä oleva toimintakehotus #1: Lataa esimerkkivaatimustenmukaisuuspaketista
Tarkista anonymisoitu, auditointivalmiit OEM-dokumentit ennen vähimmäistilausmäärän vahvistamista tai markkinoille lanseerauksen viimeistelyä.
Alueelliset tarkastuskehykset (toteutukseen keskittyvät)
Tarkastukset vaihtelevat alueittain, mutta logiikka on johdonmukainen: sääntelyviranomaiset arvioivat ensin tuotteen riskin, sitten dokumentaation ja vasta viimeisenä merkinnät. Eroa on siinä, missä valvonta tapahtuu.
Yhdysvallat — FDA ja MoCRA
Yhdysvaltain valvonta keskittyy yhä enemmän FDA:n suunhoidon auditointivaatimuksiin. MoCRA-suunhoidon noudattaminen suuhygieniabrändien markkinoille tulon jälkeisen vastuun laajentaminen.
- Kosmeettisten ja käsikauppalääkkeiden välinen päätöksentekopuu
Virheellinen luokittelu on yleinen syy valvonnan aloittamiseen.
- Laitoksen rekisteröinti ja tuotelistaus
Tilintarkastajat tarkistavat MoCRA-rekisteröinnin oikeellisuuden ja SKU-yhteensopivuuden.
- Erätietueet ja haittatapahtumiin valmistautuminen
Tuotemerkkien on osoitettava jäljitettävyys ja valitusten käsittelyjärjestelmät.
- Valkaisevia väitteitä: missä brändit ylittävät rajan
Liioiteltuja valkaisuväitteitä käytetään usein lääkeainetutkimuksen aloittamiseen.
Euroopan unioni — CPNP ja PIF
EU:n suunhoitovaatimustenmukaisuus CPNP- ja PIF-ohjeiden kautta edellyttää täydellistä yhdenmukaisuutta suunhoitotuotteiden koostumuksen, merkintöjen ja CPSR-vaatimusten välillä, ja vastuu on vastuuhenkilöllä.

- Vastuuhenkilön (RP) rooli
Vastuullisen vastuuhenkilön on hallittava ja käytettävä koko tuotetietotiedostoa.
- Turvallisuusarvioinnin odotukset
Yleisiä suunhoitotuotteita hylätään usein.
- Stabiilisuus-, CPSR- ja merkintätarkastukset
Epäjohdonmukaisuudet dokumenttien välillä ovat yleisiä epäonnistumiskohtia.
- Maahantuojan vastuu
Vastuu on rekisterinpitäjällä tai maahantuojalla, ei alkuperäisvalmistajan (OEM).
Lähi-itä — GSO 1943
GSO 1943 -suunhoidon rekisteröinti asettaa tullille valvontapaineita, mikä tekee merkintöjen tarkkuudesta ja toimituksen johdonmukaisuudesta ratkaisevan tärkeää lähetysten tullauksen kannalta.
- Tuotteiden rekisteröintiaikataulut
Puutteelliset lähetykset usein käynnistävät prosessin uudelleen.
- Arabialaiset merkintävaatimukset
Puuttuvat tai virheelliset arabiankieliset alaotsikot aiheuttavat usein lähetysten odotusaikoja.
- Tullitakavaroinnin yleisiä syitä
Lähetyksen jälkeiset tunnistemuutokset ja dokumentaation ristiriitaisuudet.
Mikrotapaus: EU:n tulli pidätti tavaransa asiakirjojen katoamisen vuoksi
Eurooppalainen jakelija toi maahan fluorivalkaisevaa hammastahnaa, jota oli valmistanut alemman tason OEM-valmistaja. Vaikka koostumus itsessään oli vaatimusten mukainen, lähetys pysäytettiin tullissa tuotetietotiedoston (PIF), stabiiliustietojen ja lopullisten etikettiväitteiden välisten epäjohdonmukaisuuksien vuoksi. CPSR viittasi aiempaan koostumusversioon; reaaliaikaista stabiiliustarkastusta ei ollut aloitettu, ja valkaisuväitteet ylittivät turvallisuusarvioijan hyväksymät tiedot.
Tuloksena oli neljän viikon tullipysäys, pakollinen uudelleenmerkintä ja 11 800 euroa suunnittelemattomia kustannuksia – samalla kun varastopääoma oli käyttämätön. Jos formulaatioversiot, stabiiliusprotokollat ja väitteiden perustelut olisi lukittu ennen lähettämistä, lähetys olisi voitu hyväksyä ilman väliintuloa.
Tästä syystä kokeneet suuhygieniatuotteiden valmistajat suorittavat rinnakkaisia stabiiliustestejä, jäädyttävät formulaatioversiot ennen tuotetiedustelun (PIF) viimeistelyä ja suorittavat korvausvaatimusten riskitarkastuksia ennen kuvien hyväksymistä – estäen dokumentaation ajautumisen, jonka tarkastajat huomaavat välittömästi.
Vastuun selvennys
Vahva suuhygieniatuotteiden OEM GMP-vaatimustenmukaisuus, jota tukee ISO 22716 -suunhoitotuotteiden valmistusstandardi, varmistaa, että tarkastajat voivat varmistaa suuhygieniatuotteiden erien jäljitettävyysvaatimukset ilman korjaavia toimenpiteitä tai takaisinvetoja.
Oralabxilla tuemme brändejä erottamalla oikeudellisen vastuun selkeästi toteutustuesta – toimitamme eräkohtaista, auditointivalmista dokumentaatiota ja merkitsemme luokittelu- ja korvausriskit ennen kuin niistä tulee täytäntöönpano-ongelmia.
Maahantuojan vs. alkuperäislaitevalmistajan vastuu (selkeysosio)
Vastuiden selkeä jako on välttämätöntä suunhoitotarkastusten läpäisemiseksi ja markkinoille saattamisen jälkeisen vastuun välttämiseksi. Sääntelyviranomaiset eivät arvioi "aikomusta" tai epävirallisia käsityksiä – he arvioivat, kuka on oikeudellisesti vastuussa ja kuka hallinnoi asiakirjoja. Kun roolit ovat epäselvät, täytäntöönpanosta vastaa maahantuoja, vaikka alkuperäinen laitevalmistaja olisi suorittanut suurimman osan vaatimustenmukaisuuteen liittyvistä tehtävistä.
Mistä maahantuoja on lain mukaan vastuussa
Alkuperäislaitevalmistajien tuesta riippumatta sääntelyviranomaiset asettavat lopullisen vastuun tuotteen markkinoille saattavalle osapuolelle. Maahantuojat eivät voi ulkoistaa näitä velvoitteita ilman nimenomaista laillista uudelleenmääräystä.

- Markkinoille lupa
Oikeudellisen hyväksynnän varmistaminen ennen myyntiä.
- Korvaushakemusten hyväksyminen
Kaikki markkinointiin ja pakkaukseen liittyvät väitteet kuuluvat maahantuojan vastuulle.
- Vähittäiskaupan dokumentaation säilytys
Maahantuojien on säilytettävä ja esitettävä pyynnöstä vaatimustenmukaisuusasiakirjat, mukaan lukien tuotetietolomakkeet (PIF), laatutodistukset (CoAs), käyttöturvallisuustiedotteet (SDS) ja erän jäljitettävyystiedot.
Mitä pätevän OEM-valmistajan on tarjottava
Pätevä suuhygieniatuotteiden valmistaja tukee vaatimustenmukaisuuden toteutumista toimittamalla todennettavissa olevaa, auditointivalmista dokumentaatiota, joka on sidottu suoraan jokaiseen tuotantoerään.
- GMP-sertifiointi
Nykyinen, alueella tunnustettu GMP-sertifiointi (esim. ISO 22716), joka osoittaa valvotut valmistus-, hygienia- ja laatujärjestelmät.
- Erätiedot ja jäljitettävyys
Täydelliset erävalmistuksen kirjaukset, eräkoodaus ja takaisinvedon jäljitettävyys, joka yhdistää raaka-aineet, tuotantoerät ja valmiit tuotteet.
- CoA, SDS, stabiilius- ja mikrobiraportit
Eräkohtaiset analyysitodistukset, käyttöturvallisuustiedotteet, stabiiliustutkimukset ja mikrobi-/altistustestiraportit lopullisen koostumuksen mukaisesti.
- Vientidokumentaatio
Tarkat kaupalliset laskut, pakkauslistat, ilmoitukset ja vientiä tukevat asiakirjat, jotka ovat yhdenmukaisia rekisteröityjen tuotetietojen ja merkintöjen kanssa.
Visuaalinen paikkamerkki #2: Maahantuojan ja OEM-valmistajan vastuualueiden taulukko
Tämä taulukko selventää, miten sääntelyviranomaiset jakavat vastuun suunhoidon auditoinneissa ja missä OEM-valmistajien tuki päättyy ja oikeudellinen vastuu alkaa.
Maahantuojan vs. alkuperäisvalmistajan vastuu (suunhoidon vaatimustenmukaisuus)
| Vaatimustenmukaisuusalue | Maahantuoja (oikeudellinen vastuu) | OEM (suoritustuki) |
| Tuoteluokitus | Lopullinen luokittelupäätös | Formulaatiotiedot ja riskimerkinnät |
| Markkinoille lupa | Rekisteröityminen, ilmoittaminen, vastuuhenkilön nimittäminen | Tietojen ja asiakirjojen valmistelu |
| Korvaushakemusten hyväksyminen | Väitteen laillisuus ja perustelut | Vahinkoriskin tarkistus ja datatuki |
| GMP-vaatimustenmukaisuus | Vahvistaa OEM-kelpoisuuden | Ylläpitää GMP-järjestelmiä ja auditointeja |
| Erän jäljitettävyys | Säilyttää ja tuottaa tietoja | Luo erätietueita ja eräkoodeja |
| Vakaus- ja turvallisuustiedot | Varmistaa markkinoiden riittävyyden | Suorittaa testejä ja antaa raportteja |
| Merkintävaatimustenmukaisuus | Lopullinen etiketin hyväksyntä | Kuvituksen tarkistus ja muotoiluohjeet |
| Vähittäiskaupan auditointivalmius | Asiakirjojen säilytys | Asiakirjojen toimitus ja päivitykset |
| Valvonta ja takaisinvedot | Taloudellinen ja oikeudellinen vastuu | Tekninen tutkimustuki |
Keskeinen selvennys:
Alkuperäislaitevalmistajat mahdollistavat vaatimustenmukaisuuden, mutta maahantuojat kantavat sääntelyyn liittyvän riskin, ellei vastuuta siirretä sopimuksella. Tämä ero on keskeinen auditointitulosten ja markkinoille saattamisen jälkeisen altistuksen kannalta.
Mitä HYVÄ OEM-valmistaja todellisuudessa tekee tarkastuksen aikana
Klo RUIQIGO, Auditointeja ei käsitellä dokumenttitapahtumina. OEM-tiimimme suunnittelevat valmistusjärjestelmät sääntelytarkastuspisteiden ympärille alusta alkaen – upottamalla erän jäljitettävyyden, aktiivisen valvonnan ja vaatimustenmukaisuuden varmentamisen suoraan päivittäiseen tuotantoon.
OEM-vaatimustenmukaisuuden työnkulku (todellinen toteutus)
Auditoinnissa pätevät laitevalmistajat osoittavat vaatimustenmukaisuuden prosessinohjauksen, eivätkä reaktiivisen paperityön, avulla. Auditoijat arvioivat, ovatko järjestelmät osa päivittäistä valmistustoimintaa.
- Penkkiformulaation validointi
Formulaatiot validoidaan laboratoriossa vaikuttavien aineiden pitoisuuksien, pH-alueen ja ainesosien yhteensopivuuden varmistamiseksi ennen skaalautumista.
- Nopeutettu + reaaliaikainen vakaus
Nopeutettu stabiilius tukee hakemusten nopeaa lähettämistä, ja reaaliaikaisia tutkimuksia suoritetaan rinnakkain säilyvyyden validoimiseksi ja formulaatiossa tapahtuvien muutosten havaitsemiseksi.
- Erätaulukon luonti
Jokaista tuotantoajoa tukevat eräarkit, jotka dokumentoivat raaka-aineet, prosessiparametrit, prosessinaikaiset kontrollit ja eräkoodit.
- Mikrobien ja kemiallisten testien
Valmiille tuotteille tehdään mikrobitestaus ja kemiallinen tarkastus turvallisuuden, säilöntäkyvyn ja vaikuttavien aineiden vaatimustenmukaisuuden varmistamiseksi.
- CoA-myöntäminen
Eräkohtaiset analyysitodistukset myönnetään ja tarkistetaan spesifikaatioita vasten ennen julkaisua.
- Vienti- ja tulliasiakirjat
Lähetysasiakirjat, ilmoitukset ja vaatimustenmukaisuustiedostot yhdenmukaistetaan rekisteröityjen tuotetietojen kanssa tulliristiriitojen välttämiseksi.
Miten matalan tason valmistajat epäonnistuvat
Tarkastusvirheet johtuvat usein systeemisistä heikkouksista pikemminkin kuin yksittäisistä virheistä. Alemman tason valmistajat tyypillisesti puuttuu vaatimustenmukaisuuteen liittyvä infrastruktuuri ja reagoidaan vasta ongelmien ilmetessä.
- Erän jäljitettävyys puuttuu
Puutteelliset tai epäjohdonmukaiset erätiedot estävät tehokkaat takaisinvedot ja heikentävät välittömästi tilintarkastajien luottamusta.
- Yleisen käyttöturvallisuustiedotteen uudelleenkäyttö
Kierrätetyt tai eräkohtaiset käyttöturvallisuustiedotteet (SDS) viestivät huonosta formulaation hallinnasta ja ne merkitään usein auditointien aikana.
- Ei vahinkoriskin tarkistusta
Valmistajat, jotka eivät arvioi markkinointiväitteisiin liittyvää sääntelyriskiä, altistavat tuotemerkit virheelliselle luokittelulle ja täytäntöönpanotoimille.
- Reaktiivinen (ei proaktiivinen) vaatimustenmukaisuus
Vaatimustenmukaisuutta käsitellään viime hetken asiakirjapyyntönä pikemminkin kuin integroituna valmistusjärjestelmänä, mikä johtaa viivästyksiin, korjaaviin toimenpiteisiin ja epäonnistuneisiin auditointeihin.
OEM-noutolaatikko:
Vaatimustenmukaisuusongelmat ovat valmistusvirheitä, eivät paperityöhön liittyviä ongelmia. Tilintarkastajat rankaisevat heikkoja järjestelmiä, eivät puuttuvia tiedostoja.
Artikkelin puolivälissä tapahtuva toimintakehotus #2: Pyydä RP:n / MoCRA:n konsultaatiopuhelua
Selvitä maahantuojan vastuu, tuoteluokittelun riskit ja dokumentaation puutteet vaatimustenmukaisuusasiantuntijan kanssa ennen määräysten mukaisen toimittamisen tai lähettämisen.
Visualisoitu auditointiaikajana (valinnainen, mutta vahva)
Auditointien aikataulut vaihtelevat alueittain, mutta viivästyksiä esiintyy jatkuvasti samoissa toteutusvaiheissa – luokittelupäätöksissä, puutteellisessa dokumentaatiossa ja myöhäisvaiheen merkintäkorjauksissa. Ymmärtämällä, missä aikaa todellisuudessa menetetään, brändit voivat suunnitella lanseeraukset realistisesti ja välttää varastojen pysähtymisen.

Visuaalinen paikkamerkki #3: Auditointiaikajanakaavio (Yhdysvallat vs. EU vs. Lähi-itä)
Suunhoidon auditoinnin aikajanan vertailu
| Auditointivaihe | Yhdysvallat (FDA / MoCRA) | Euroopan unioni (CPNP / PIF) | Lähi-itä (GSO 1943) |
| Tuoteluokitus | Kosmeettinen vs. OTC-päätös | Kosmeettinen luokittelu | Kosmeettinen luokittelu |
| Laitoksen / OEM-kelpoisuus | Laitoksen rekisteröinti | OEM-hyväksyntä RP:n kautta | OEM-tietojen tarkastelu |
| Turvallisuus- ja vakaustarkastus | Rajoitettu ennakkomyynti | CPSR + vakaustarkastelu | Vakauskatsaus |
| Väitteiden ja merkintöjen tarkistus | Kohtalainen | Tiukka, markkinoilletuloa edeltävä | Tiukka, markkinoilletuloa edeltävä |
| Rekisteröinti/ilmoitus | Tuotelistaus | CPNP-ilmoitus | Tuotteen rekisteröinti |
| Tulli ja selvitys | Markkinoille saattamisen jälkeinen valvonta | Minimaalinen rajalla | Tiukka valvonta |
| Markkinoille tulo | Aikainen sisäänpääsy sallittu | Hyväksynnän jälkeinen merkintä | Hyväksynnän jälkeinen merkintä |
| Markkinoille saattamisen jälkeinen valvonta | Korkea | Kohtalainen | Matala-Kohtalainen |
OEM-yhteenveto:
Markkinoille saamisaikaa lyhentävät rinnakkaiset vaatimustenmukaisuustyönkulut, eivät vaiheiden ohittaminen.
Loppupäätelmä (kaupallinen päätös)
Pitkäaikainen menestys suunhoidossa riippuu strukturoiduista järjestelmistä, ei reaktiivisesta paperityöstä. Tuotemerkit, jotka käsittelevät suunhoitotuotteiden auditointeja ja vaatimustenmukaisuutta valmistusprosessina, eivätkä toimitustehtävänä, suojaavat katteita, aikatauluja ja jälleenmyyjien luottamusta. Hammastahna-, suuvesi- tai valkaisuainevalikoimaa skaalaaville tuotemerkeille Oralabx toimii vaatimustenmukaisuuden toteutuskumppanina – yhdenmukaistaen formulaatio-, dokumentaatio- ja eräkäsittelyjärjestelmät auditointitilanteen mukaan Yhdysvalloissa, EU:ssa ja Lähi-idässä, jotta viranomaishyväksyntä muunnetaan ennustettavaksi markkinoillepääsyksi.
UKK
K1. Kuka on oikeudellisesti vastuussa, jos suunhoidon tarkastus epäonnistuu – maahantuoja vai alkuperäinen laitevalmistaja?
Maahantuoja on oletusarvoisesti laillisesti vastuussa. Laitevalmistajat voivat tukea vaatimustenmukaisuuden toteuttamista, mutta vastuu siirtyy vain, jos se on nimenomaisesti siirretty sopimuksella ja sääntelyviranomaiset hyväksyvät sen.
K2. Edellyttääkö yksittäispakattujen suuvesien pakkaukset täydellistä vaatimustenmukaisuusdokumentaatiota?
Kyllä. Pussimuodot eivät ole vapautettuja. Auditoijat arvioivat koostumuksen, väitteet ja turvallisuustiedot pakkauskoosta riippumatta.
K3. Voidaanko yksittäispakkauksessa olevia suuvesinäytteitä lähettää ilman käyttöturvallisuustiedotetta tai aitoustodistusta?
Useimmissa tapauksissa ei. Näytteet voivat liikkua rajoitetuin poikkeuksin, mutta tullissa vaaditaan yleensä käyttöturvallisuustiedote ja luotettava todistus, erityisesti nestemäisten suuhygieniatuotteiden osalta.
K4. Kuinka kauan ennen julkaisua vaatimustenmukaisuustyön tulisi alkaa?
Ihannetapauksessa 3–6 kuukautta ennen lanseerausta. Aktiivisia aineita tai valkaisevia väitteitä sisältävien tuotteiden vaatimustenmukaisuuden suunnittelu tulisi aloittaa vielä aikaisemmin.
K5. Edellyttääkö Amazon-listaukset CoA:ta tai SDS:ää?
Amazon pyytää usein CoA:ita, SDS:iä ja vaatimustenmukaisuusasiakirjoja listautumisen hyväksynnän tai listautumisen jälkeisten tarkastusten aikana, erityisesti suuhygieniatuotteiden osalta.
K6. Mitä asiakirjoja on säilytettävä jälleenmyyjän tasolla?
Jälleenmyyjät tarvitsevat tyypillisesti pyynnöstä pääsyn CoAs-asiakirjoihin, SDS-tietoihin, erän jäljitettävyystietoihin ja todisteeseen myyntiluvasta.
K7. Lasketaanko valkaisuun liittyvät väitteet Yhdysvalloissa lääkeväitteiksi?
Kyllä ne voivat. Väitteet pysyvästä valkaisusta, kiilteen muuttumisesta tai terapeuttisista vaikutuksista johtavat usein lääketason tarkasteluun.
K8. Voiko EU:n vastuuhenkilö hoitaa myös GCC-markkinoita?
Ei. GCC-markkinat vaativat erilliset paikalliset rekisteröinti- ja vaatimustenmukaisuusprosessit; EU:n rekisteritodistus ei automaattisesti kata Lähi-idän sääntelyyn liittyviä velvoitteita.
Lopullinen toimintakehotus: Vaatimustenmukaisuuden tarkistuslista PDF-muodossa
Vältä tarkastusviiveet, uudelleenmerkintäkustannukset ja tullivaraukset.
Lataa suunhoidon vaatimustenmukaisuuden tarkistuslistamme PDF-muodossa tai keskustele suoraan asiantuntijan kanssa OEM-vaatimustenmukaisuuden asiantuntija validoidaksesi dokumentaatiosi ennen julkaisua.







