Introdução
Este guia foi escrito para líderes de compras, fundadores de marcas e gerentes de conformidade que trabalham com o fornecimento de cremes dentais, enxaguantes bucais e produtos clareadores, responsáveis por obter a aprovação e a disponibilidade dos produtos de higiene bucal nas prateleiras. Auditorias e conformidade de produtos de higiene bucal são as principais causas de atrasos no lançamento, retenções alfandegárias, custos de reetiquetagem e falhas na integração ao varejo — e não a qualidade da formulação.

Cuidados bucais faciais A fiscalização é mais rigorosa do que a de cosméticos em geral devido aos ingredientes ativos, às alegações e à rastreabilidade dos lotes, e uma retenção alfandegária de 4 semanas pode reter valores na ordem de grandeza (MOQ). Este artigo detalha a lógica de auditoria região por região, os requisitos específicos para higiene bucal e as responsabilidades claras do fabricante original (OEM) e do importador.
No Oralabx, Trabalhamos com marcas especificamente nesse ponto crítico — onde a formulação pode estar pronta, mas a execução da conformidade determina se um SKU realmente chegará ao mercado.
Como funcionam na prática as auditorias de saúde bucal (obrigatórias vs. opcionais)
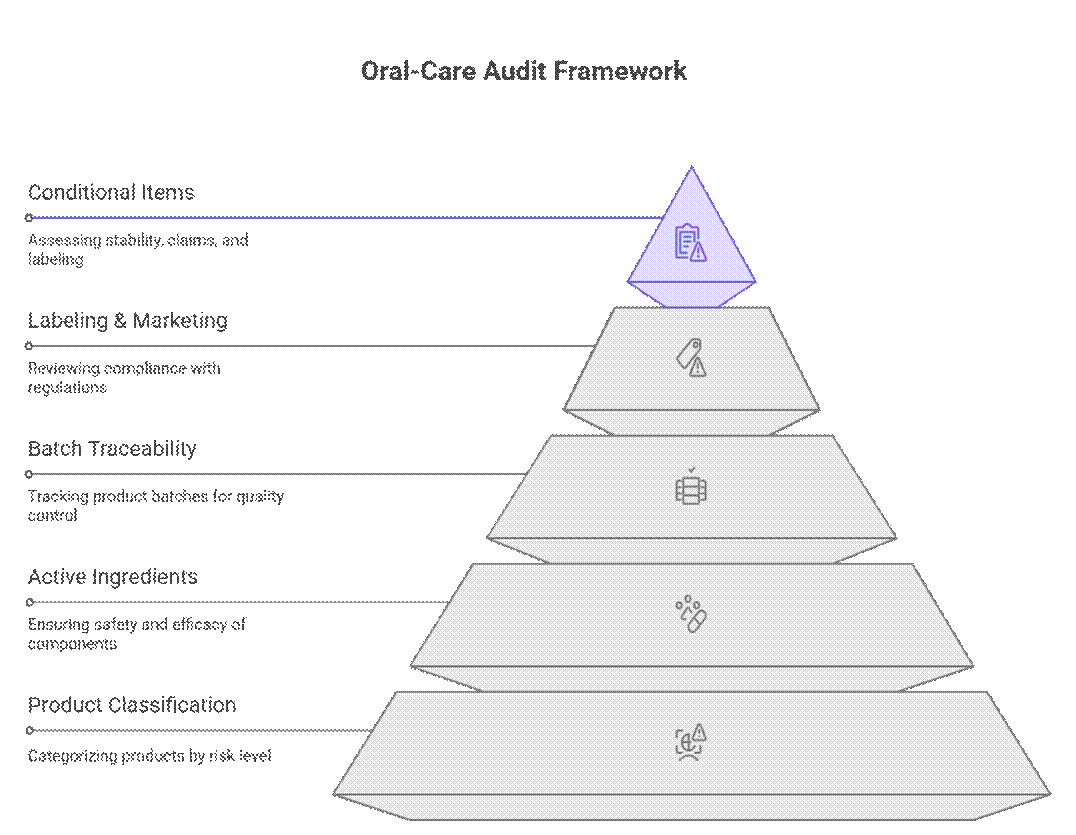
Os órgãos reguladores abordam as auditorias e a conformidade de produtos de higiene bucal utilizando uma estrutura hierárquica baseada em risco, que prioriza a classificação do produto, os ingredientes ativos e a rastreabilidade do lote antes da revisão da rotulagem ou da comercialização. Somente após a aprovação nessas etapas é que são analisados itens condicionais, como duração da estabilidade, comprovação das alegações ou rotulagem transitória.
O que os auditores verificam primeiro (Não negociável)
Os auditores começam com um conjunto rigoroso de requisitos que devem ser cumpridos antes que qualquer revisão adicional possa prosseguir.
- Classificação do produto (cosmético vs. medicamento de venda livre / quase-medicamento)
A classificação incorreta continua sendo uma das falhas mais comuns nos requisitos de auditoria de pastas de dente, principalmente quando as marcas interpretam erroneamente a classificação de produtos de higiene bucal como cosméticos ou produtos de venda livre, em relação aos limites de ingredientes ativos e alegações.
- Limites de ingredientes ativos
Verifica a conformidade com os limites para ingredientes como flúor ou CPC, que podem desencadear a fiscalização de medicamentos isentos de prescrição ou de nível farmacêutico.
- Registro do fabricante e status GMP
Garante que as instalações do fabricante original (OEM) estejam devidamente registradas e operem de acordo com as normas GMP aprovadas. produção de cuidados bucais.
- Rastreabilidade de lotes e prontidão para recall
Confirma a existência de registros completos de lotes para rastrear, isolar e recolher produtos rapidamente, caso seja exigido por órgãos reguladores ou varejistas.
O que é um requisito condicional?
Além dos itens não negociáveis, os auditores aplicam uma revisão baseada em risco à documentação e aos testes. A aplicação dessas normas varia de acordo com o mercado e o risco do produto, mas as lacunas geralmente levam a atrasos ou aprovações condicionais.
- Duração da estabilidade (acelerada vs. em tempo real)
A estabilidade acelerada pode ser suficiente para lançamentos iniciais ou de baixo risco, mas a estabilidade em tempo real é frequentemente necessária para produtos com ingredientes ativos, prazos de validade mais longos ou mercados mais rigorosos, como a UE ou o CCG. Fabricantes de equipamentos originais (OEMs) de grande porte executam testes de estabilidade em tempo real em paralelo.
- Profundidade da comprovação da alegação
Alegações cosméticas básicas geralmente exigem justificativas mínimas, enquanto alegações de desempenho necessitam de dados laboratoriais ou clínicos. Os auditores sinalizam alegações que carecem de evidências ou que não correspondem à formulação final.
- Idioma local e formatos de rotulagem
Rótulos em inglês podem ser aceitos para revisão, mas a aprovação final geralmente exige rotulagem em conformidade com o idioma local. Os auditores costumam sinalizar a ausência de sub-rótulos, nomes de ingredientes incorretos ou traduções de alegações que possam gerar riscos.
O que é negociável (com um fabricante de equipamento original forte)
Embora as regulamentações pareçam rígidas, auditores experientes reconhecem as realidades práticas da fabricação. Com um fabricante de equipamento original (OEM) comprovado e um roteiro de conformidade claro, alguns requisitos podem ser implementados em fases ou sequenciados sem impedir a entrada no mercado.

- Rotulagem transitória
Os auditores podem aceitar a rotulagem provisória para lotes iniciais, desde que a arte final seja aprovada e o processo de finalização seja concluído. Fabricantes de equipamentos originais (OEMs) rigorosos aplicam a segregação de lotes e impedem que rótulos não finais cheguem ao varejo.
- Documentação em etapas durante a ampliação de escala
Os auditores podem aceitar a rotulagem provisória para lotes iniciais, desde que a arte final seja aprovada e o processo de finalização seja concluído. Fabricantes de equipamentos originais (OEMs) rigorosos aplicam a segregação de lotes e impedem que rótulos não finais cheguem ao varejo.
- Testes paralelos durante as fases piloto.
Fabricantes de equipamentos originais (OEMs) de grande porte realizam testes de estabilidade, microbiológicos e de embalagem durante os lotes piloto, reduzindo semanas ou meses nos prazos de lançamento.
Espaço reservado visual #1: Hierarquia de requisitos de auditoria (produtos de higiene bucal)
| Nível de prioridade da auditoria | Categoria de Requisito | O que isto inclui | Impacto na auditoria em caso de ausência de dados |
| Nível 1 — Não negociável | Classificação do produto | Determinação de cosméticos versus medicamentos de venda livre/quase-medicamentos, limites de ingredientes ativos | Falha imediata na auditoria ou retenção alfandegária |
| GMP e status das instalações | ISO 22716, registro na FDA, controles de higiene | Rejeição de remessa, desqualificação da fábrica | |
| Rastreabilidade de lotes | Registros de lote, prontidão para recall, codificação de lote | Ação corretiva obrigatória, possível recolhimento de bens | |
| Nível 2 — Condicionalmente Obrigatório | Suporte de estabilidade | Estabilidade acelerada e/ou em tempo real relacionada à vida útil do produto. | Aprovação condicional, obrigação pós-mercado |
| Comprovação da alegação | Dados que comprovam alegações de clareamento, flúor, placa bacteriana e CPC | É necessário remover ou reetiquetar a reclamação. | |
| Conformidade com a rotulagem local | Convenções de idioma, formato e nomenclatura de ingredientes | Custos de reetiquetagem, atraso no lançamento | |
| Nível 3 — Negociável (Depende do Fabricante Original) | Rotulagem transitória | Arte provisória com versões finais aprovadas em arquivo. | Aceito com plano de extinção documentado |
| Documentação em etapas | Testes de longo prazo adiados durante a ampliação da escala | Aceito se avaliado quanto aos riscos e programado. | |
| Testes paralelos | Testes de estabilidade e microbiológicos durante as produções piloto. | Aceito com rigorosos controles de lote. |
Conclusão para o fabricante original do equipamento (OEM):
As marcas falham nas auditorias ao tratarem os itens de Nível 2 e Nível 3 como palpites opcionais em vez de riscos gerenciados. Um fabricante de equipamento original (OEM) forte controla essa hierarquia de forma proativa.
Marcas que deixaram de atender aos itens de auditoria específicos para cuidados bucais
A maioria das reprovações em auditorias de produtos de higiene bucal não é causada pela falta de certificados. Elas ocorrem quando as marcas aplicam suposições cosméticas genéricas a produtos de maior risco, que contêm ingredientes ativos, alegações funcionais e são de uso diário.

Os auditores concentram-se nesses detalhes específicos de higiene oral desde o início, e as lacunas frequentemente levam a atrasos, reetiquetagem ou ações corretivas.
Itens de auditoria específicos para pasta de dente
Os cremes dentais são auditados de forma mais rigorosa devido às alegações de ação ativa e terapêutica.
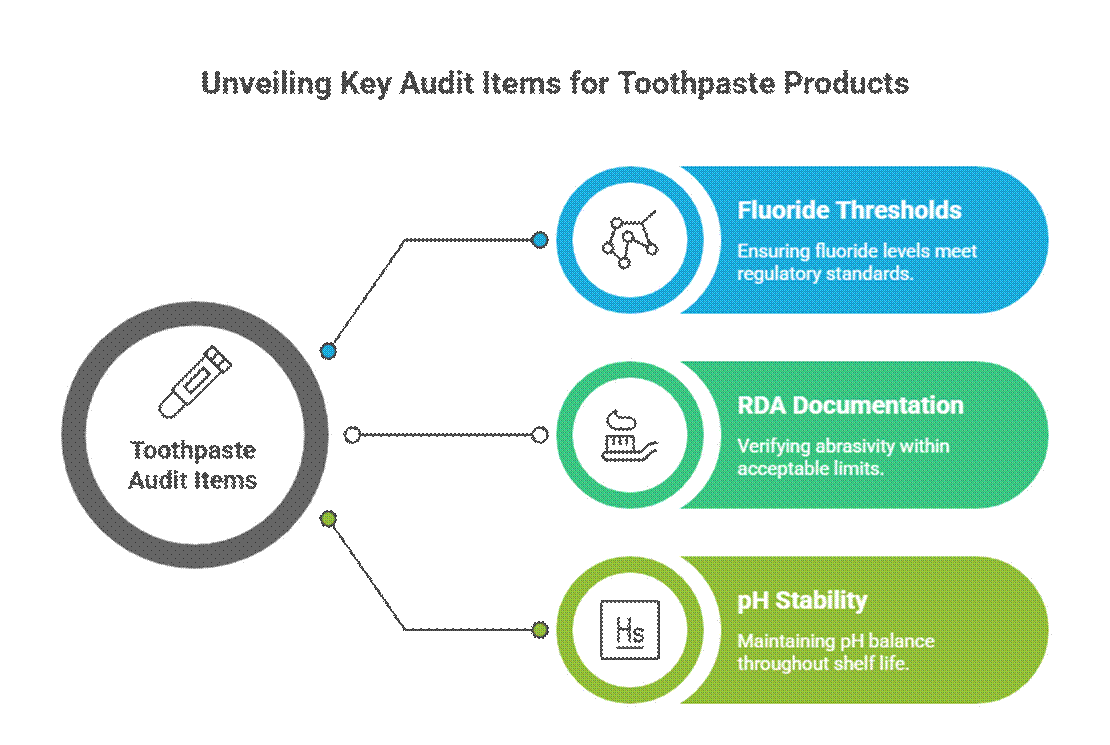
- Limiares de fluoreto (relevância da monografia da FDA)
Nos Estados Unidos, pasta de dentes com flúor Deve cumprir a monografia da FDA para creme dental com flúor, incluindo concentração do princípio ativo, formato da rotulagem e alinhamento das alegações. Os auditores também esperam documentação da RDA para o creme dental e requisitos validados de testes de estabilidade para cuidados bucais durante todo o prazo de validade.
- Documentação RDA (limites de abrasividade)
Os auditores esperam que os dados de Abrasividade Relativa da Dentina (RDA) confirmem a segurança do esmalte. Valores de RDA ausentes ou excessivos são um sinal de alerta comum, especialmente para formulações clareadoras ou com carvão ativado.
- Estabilidade do pH durante o prazo de validade
O pH do creme dental deve permanecer dentro de uma faixa segura e funcional durante todo o seu prazo de validade. Os auditores revisam os dados de estabilidade para garantir que a variação do pH não comprometa a eficácia do flúor ou a segurança bucal.
Itens de auditoria específicos para enxaguante bucal
Auditorias de conformidade com enxaguantes bucais O foco principal está no controle microbiano e na concentração do princípio ativo, especialmente para fórmulas que exigem documentação de conformidade com o protocolo CPC para enxaguantes bucais e testes de eficácia de conservantes.
- Classificações: sem álcool vs. com álcool
Os cremes dentais são auditados de forma mais rigorosa devido às alegações de ação ativa e terapêutica.
- Documentação CPC %
Os auditores verificam os limites de concentração e a conformidade das alegações para fórmulas que contêm CPC.
- Relatórios de testes de desafio microbiano
A ausência ou a falta de testes de desafio geralmente levam a aprovações condicionais.
- Testes de eficácia de conservantes
Sistemas de conservação fracos são considerados riscos à segurança do produto.
Sinais de alerta em produtos clareadores
Os auditores examinam minuciosamente as alegações regulamentares dos cremes dentais clareadores, em particular a linguagem que implica modificação do esmalte, clareamento permanente ou resultados terapêuticos que possam desencadear uma fiscalização a nível de medicamento.

- Alegações de clareamento versus alegações sobre medicamentos (EUA)
Alegações que impliquem alteração do esmalte ou resultados terapêuticos podem levar à classificação do medicamento.
- Divulgação sobre peróxidos/não peróxidos
Os auditores exigem a divulgação clara dos princípios ativos clareadores e suas concentrações.
- A redação da alegação que desencadeia uma revisão regulatória.
Os auditores exigem a divulgação clara dos princípios ativos clareadores e suas concentrações.
Conclusão para o fabricante original do equipamento (OEM):
As auditorias de produtos para higiene bucal falham em relação aos ingredientes ativos e às alegações, não à estética da embalagem.
CTA #1 no meio do artigo: Baixe o pacote de conformidade de amostra
Analise a documentação OEM anonimizada e pronta para auditoria antes de definir a quantidade mínima de encomenda (MOQ) ou finalizar o lançamento no mercado.
Estruturas Regionais de Auditoria (Focadas na Execução)
As auditorias variam conforme a região, mas a lógica é consistente: os órgãos reguladores avaliam primeiro o risco do produto, em segundo lugar a documentação e, por último, a rotulagem. O que difere é o local onde a fiscalização ocorre.
Estados Unidos — FDA e MoCRA
Nos EUA, a fiscalização concentra-se cada vez mais nos requisitos de auditoria de cuidados bucais da FDA, com Conformidade com os cuidados bucais do MoCRA Ampliar a responsabilidade pós-comercialização das marcas de higiene bucal.
- Árvore de decisão: Cosméticos vs. Produtos de venda livre
A classificação incorreta é um motivo comum para a aplicação de medidas coercitivas.
- Cadastro de instalações e listagem de produtos
Os auditores verificam a precisão do registro no MoCRA e o alinhamento do SKU.
- Registros de lotes e preparação para eventos adversos
As marcas devem demonstrar sistemas de rastreabilidade e de tratamento de reclamações.
- Promessas de clareamento: onde as marcas ultrapassam os limites.
Alegações exageradas de clareamento da pele frequentemente levam a uma análise rigorosa dos medicamentos.
União Europeia — CPNP e PIF
A conformidade da UE com os requisitos de higiene oral, através do CPNP e do PIF, exige total alinhamento entre a formulação, a rotulagem e os requisitos do CPSR para produtos de higiene oral, sendo a responsabilidade da Pessoa Responsável.

- Função de Pessoa Responsável (PR)
O RP deve controlar e ter acesso ao arquivo completo de informações do produto.
- Expectativas de avaliação de segurança
Os pedidos genéricos de autorização de segurança de produtos de higiene oral (CPSRs) são frequentemente rejeitados.
- Verificações de estabilidade, CPSR e rotulagem.
Inconsistências entre documentos são pontos de falha comuns.
- Exposição à responsabilidade do importador
A responsabilidade recai sobre o RP ou importador, não sobre o OEM.
Oriente Médio — GSO 1943
Registro de cuidados bucais GSO 1943 Isso exerce pressão sobre a alfândega, tornando a precisão da rotulagem e a consistência das informações apresentadas cruciais para a liberação das remessas.
- Cronograma de registro de produtos
Envios incompletos geralmente reiniciam o processo.
- Requisitos de rotulagem em árabe
A ausência ou incorreção de sub-rótulos em árabe é uma causa comum de atrasos nas remessas.
- Causas comuns de apreensão alfandegária
Alterações de rótulos e inconsistências na documentação após o envio.
Microcaso: Retenção alfandegária na UE causada por desvio de documentação
Um distribuidor europeu importou um creme dental clareador com flúor produzido por um fabricante de segunda linha. Embora a formulação em si estivesse em conformidade, a remessa foi retida na alfândega devido a inconsistências entre o Arquivo de Informações do Produto (PIF), os dados de estabilidade e as alegações finais do rótulo. O Relatório de Segurança do Consumidor (CPSR) fez referência a uma versão anterior da formulação; o teste de estabilidade em tempo real não havia sido iniciado e as alegações de clareamento excediam o que o avaliador de segurança havia aprovado.
O resultado foi uma retenção alfandegária de quatro semanas, reetiquetagem obrigatória e € 11.800 em custos não planejados — enquanto o capital de estoque permaneceu ocioso. Se as versões da formulação, os protocolos de estabilidade e a comprovação das alegações tivessem sido definidos antes do envio, a remessa teria sido liberada sem intervenção.
É por isso que fabricantes de equipamentos originais (OEMs) experientes em higiene bucal realizam testes de estabilidade paralelos, congelam versões da formulação antes da finalização do PIF (Public Information Framework - Formulário de Informações de Produto) e realizam revisões de risco de alegações antes da aprovação da arte final — evitando desvios na documentação que os auditores identificam imediatamente.
Esclarecimento de responsabilidades
A forte conformidade com as Boas Práticas de Fabricação (BPF) de fabricantes de equipamentos originais (OEM) para cuidados bucais, respaldada pela norma ISO 22716 para fabricação de produtos de higiene bucal, garante que os auditores possam verificar os requisitos de rastreabilidade dos lotes de produtos de higiene bucal sem a necessidade de ações corretivas ou recalls.
Na Oralabx, apoiamos as marcas separando claramente a responsabilidade legal do suporte à execução — fornecendo documentação específica para cada lote, pronta para auditoria, e sinalizando riscos de classificação e de reivindicações antes que se tornem problemas de fiscalização.
Responsabilidade do importador versus responsabilidade do fabricante original (Seção de esclarecimento)
A clara separação de responsabilidades é essencial para a aprovação em auditorias de higiene bucal e para evitar responsabilidades pós-comercialização. Os órgãos reguladores não avaliam a "intenção" ou entendimentos informais — eles avaliam quem é o responsável legal e quem controla os documentos. Quando os papéis não estão claros, a fiscalização recai sobre o importador, mesmo que o fabricante original tenha realizado a maior parte das tarefas de conformidade.
O que o importador é legalmente responsável
Independentemente do suporte do fabricante original, os órgãos reguladores atribuem a responsabilidade final à parte que coloca o produto no mercado. Os importadores não podem terceirizar essas obrigações sem uma atribuição legal explícita.

- Autorização de comercialização
Garantir a aprovação legal antes da venda.
- Aprovação de reivindicações
Todas as alegações de marketing e nas embalagens são de responsabilidade do importador.
- retenção de documentação de varejo
Os importadores devem manter e apresentar os documentos de conformidade quando solicitados, incluindo o acesso ao PIF (Public Information File), os certificados de análise (CoAs), as fichas de dados de segurança (SDS) e os registros de rastreabilidade do lote.
O que um fabricante de equipamento original (OEM) competente deve fornecer
Um fabricante de equipamentos originais (OEM) qualificado para higiene bucal oferece suporte à conformidade fornecendo documentação verificável e pronta para auditoria, diretamente vinculada a cada lote de produção.
- Certificação GMP
Atual, Certificação GMP reconhecida regionalmente (ex.: ISO 22716) demonstrando sistemas controlados de fabricação, higiene e qualidade.
- Registros de lote e rastreabilidade
Registros completos de fabricação em lote, codificação de lotes e rastreabilidade de recalls, vinculando matérias-primas, lotes de produção e produtos acabados.
- Certificado de Análise (CoA), Ficha de Dados de Segurança (SDS), relatórios de estabilidade e microbiológicos
Certificados de análise específicos do lote, fichas de dados de segurança, estudos de estabilidade e relatórios de testes microbiológicos/de desafio alinhados à formulação final.
- Documentação de exportação
Faturas comerciais, listas de embalagem, declarações e documentos de exportação de suporte precisos e consistentes com os dados e a rotulagem do produto registrados.
Espaço reservado visual #2: Tabela de responsabilidades do importador versus OEM
Esta tabela esclarece como os reguladores atribuem responsabilidades durante as auditorias de higiene oral e onde termina o suporte do fabricante original e onde começa a responsabilidade legal.
Responsabilidade do importador versus responsabilidade do fabricante original (conformidade com os padrões de higiene bucal)
| Área de Conformidade | Importador (Responsabilidade Legal) | OEM (Suporte à Execução) |
| Classificação do produto | Decisão final de classificação | Entrada de dados para formulação e indicadores de risco |
| Autorização de comercialização | Registro, notificação, agendamento de RP | Preparação de dados e documentos |
| Aprovação de reivindicações | Alegação de legalidade e comprovação | Análise de risco de sinistros e suporte de dados |
| Conformidade com as Boas Práticas de Fabricação (BPF) | Verifica a qualificação do fabricante original (OEM). | Mantém os sistemas de Boas Práticas de Fabricação (BPF) e realiza auditorias. |
| Rastreabilidade de lotes | Conserva e produz registros | Cria registros de lote e codificação de lotes. |
| Dados de estabilidade e segurança | Garante a adequação ao mercado. | Realiza testes e emite relatórios. |
| Conformidade de rotulagem | Aprovação final do rótulo | Revisão de arte e orientações de formatação |
| Preparação para auditoria no varejo | Retenção de documentos | Fornecimento e atualização de documentos |
| Fiscalização e recolhimento de mercadorias | Responsabilidade financeira e legal | Apoio à investigação técnica |
Esclarecimento importante:
Os fabricantes de equipamentos originais (OEMs) viabilizam a conformidade, mas os importadores absorvem o risco regulatório, a menos que a responsabilidade seja contratualmente reatribuída. Essa distinção é fundamental para os resultados das auditorias e para a exposição pós-comercialização.
O que um bom fabricante de equipamento original (OEM) realmente faz durante uma auditoria
No RUIQIGO, As auditorias não são tratadas como eventos documentais. Nossas equipes de OEM projetam sistemas de fabricação com base em pontos de verificação regulatórios desde o primeiro dia, incorporando rastreabilidade de lotes, controle ativo e verificação de conformidade diretamente na produção diária.
Fluxo de trabalho de conformidade OEM (execução real)
Durante uma auditoria, os fabricantes de equipamentos originais (OEMs) competentes demonstram conformidade por meio do controle de processos, e não apenas por meio de documentação reativa. Os auditores avaliam se os sistemas estão integrados às operações diárias de fabricação.
- Validação da formulação em bancada
As formulações são validadas em escala laboratorial para confirmar as concentrações de princípios ativos, a faixa de pH e a compatibilidade dos ingredientes antes do aumento de escala.
- Estabilidade acelerada e em tempo real
A estabilidade acelerada permite submissões antecipadas, enquanto estudos em tempo real são executados em paralelo para validar o prazo de validade e detectar desvios na formulação.
- Criação de planilha de lote
Cada lote de produção é acompanhado por fichas de produção que documentam as matérias-primas, os parâmetros do processo, os controles em andamento e os códigos de lote.
- Testes microbiológicos e químicos
Os produtos acabados são submetidos a testes microbiológicos e verificação química para confirmar a segurança, o desempenho dos conservantes e a conformidade com os ingredientes ativos.
- Emissão de CoA
Os Certificados de Análise específicos para cada lote são emitidos e verificados em relação às especificações antes da liberação.
- Documentação de exportação e aduaneira
Os documentos de envio, as declarações e os arquivos de conformidade são alinhados com os dados de registro do produto para evitar discrepâncias alfandegárias.
Como os fabricantes de baixo custo falham
As falhas de auditoria geralmente remontam a fragilidades sistêmicas, e não a erros isolados. Fabricantes de nível inferior Normalmente, carecem de infraestrutura de conformidade e só respondem quando surgem problemas.
- Rastreabilidade de lote ausente
Registros de lotes inadequados ou inconsistentes impedem recalls eficazes e comprometem imediatamente a confiança dos auditores.
- Reutilização genérica de FISPQ
Fichas de dados de segurança (SDS) recicladas ou não específicas do lote indicam um controle de formulação deficiente e são frequentemente sinalizadas durante auditorias.
- Sem análise de risco de sinistro
Fabricantes que não avaliam o risco regulatório associado às alegações de marketing expõem suas marcas à classificação incorreta e a ações de fiscalização.
- Conformidade reativa (não proativa)
A conformidade é tratada como uma solicitação de documentos de última hora, em vez de um sistema de produção integrado, o que leva a atrasos, ações corretivas e auditorias reprovadas.
Caixa para viagem OEM:
As falhas de conformidade são falhas de fabricação, não problemas de documentação. Os auditores penalizam sistemas deficientes, não arquivos ausentes.
Chamada para ação (CTA) no meio do artigo #2: Solicitar consulta RP/MoCRA
Esclareça a responsabilidade do importador, os riscos de classificação do produto e as lacunas de documentação com um especialista em conformidade antes da submissão regulatória ou do envio.
Cronograma de auditoria visualizado (opcional, mas eficaz)
Os prazos de auditoria variam conforme a região, mas os atrasos ocorrem invariavelmente nos mesmos pontos de execução: decisões de classificação, documentação incompleta e correções de rotulagem em estágios avançados. Compreender onde o tempo é realmente perdido permite que as marcas planejem lançamentos de forma realista e evitem o bloqueio de estoque.

Espaço reservado visual #3: Cronograma de auditoria (EUA vs UE vs Oriente Médio)
Comparação do Cronograma de Auditoria de Cuidados Bucais
| Fase de auditoria | Estados Unidos (FDA / MoCRA) | União Europeia (CPNP / PIF) | Oriente Médio (GSO 1943) |
| Classificação do produto | Decisão entre cosméticos e medicamentos de venda livre | Classificação cosmética | Classificação cosmética |
| Qualificação de instalações/OEM | Registro de instalações | Qualificação OEM via RP | revisão de dados do OEM |
| Análise de segurança e estabilidade | Pré-mercado limitado | Revisão de estabilidade CPSR + | Revisão de estabilidade |
| Revisão de alegações e rotulagem | Moderado | Rigoroso, pré-mercado | Rigoroso, pré-mercado |
| Registro/notificação | Lista de produtos | notificação CPNP | Registro do produto |
| Desembaraço alfandegário | Fiscalização pós-mercado | Mínimo na fronteira | Alta fiscalização |
| Entrada no mercado | Entrada antecipada permitida | Entrada após aprovação | Entrada após aprovação |
| Fiscalização pós-mercado | Alto | Moderado | Baixo-Moderado |
Conclusão para o fabricante original do equipamento (OEM):
O tempo de lançamento no mercado é reduzido por fluxos de trabalho de conformidade paralelos, e não pela omissão de etapas.
Conclusão (Encerramento Comercial)
O sucesso a longo prazo no setor de higiene bucal depende de sistemas estruturados, não de burocracia reativa. Marcas que tratam auditorias e conformidade de produtos de higiene bucal como uma disciplina de fabricação, e não como uma tarefa de submissão, protegem suas margens de lucro, prazos e a confiança dos varejistas. Para marcas que expandem seus produtos de creme dental, enxaguante bucal ou clareadores, a Oralabx atua como parceira na execução da conformidade, alinhando formulação, documentação e sistemas de lote às realidades das auditorias nos EUA, na UE e no Oriente Médio, para que a aprovação regulatória se converta em acesso previsível ao mercado.
Perguntas frequentes
P1. Quem é o responsável legal se uma auditoria de higiene bucal falhar — o importador ou o fabricante original do equipamento (OEM)?
Por padrão, o importador é legalmente responsável. Os fabricantes de equipamentos originais (OEMs) podem auxiliar na execução do cumprimento das normas, mas a responsabilidade só é transferida se expressamente reatribuída por contrato e aceita pelos órgãos reguladores.
P2. Os produtos de enxaguante bucal em sachê individual exigem documentação de conformidade completa?
Sim. Os formatos em sachê não são isentos. Os auditores avaliam a formulação, as alegações e os dados de segurança independentemente do tamanho da embalagem.
P3. É possível enviar amostras individuais de enxaguante bucal em sachê sem a FISPQ ou o Certificado de Análise?
Na maioria dos casos, não. Amostras podem ser transportadas em casos excepcionais, mas a FISPQ (Ficha de Informações de Segurança de Produtos Químicos) e o Certificado de Análise (CoA) são geralmente exigidos na alfândega, especialmente para produtos líquidos de higiene bucal.
Q4. Quanto tempo antes do lançamento o trabalho de conformidade deve começar?
Idealmente, de 3 a 6 meses antes do lançamento. Produtos com ingredientes ativos ou que alegam clareamento devem iniciar o planejamento de conformidade ainda mais cedo.
Q5. Os anúncios da Amazon exigem certificado de análise (CoA) ou ficha de dados de segurança (SDS)?
A Amazon frequentemente solicita certificados de análise (CoAs), fichas de dados de segurança (SDS) e documentos de conformidade durante a aprovação de anúncios ou em auditorias pós-anúncio, principalmente para produtos de higiene bucal.
Q6. Quais documentos devem ser mantidos no nível do varejista?
Normalmente, os varejistas exigem acesso a certificados de análise (CoAs), fichas de dados de segurança (SDS), registros de rastreabilidade de lotes e comprovante de autorização de comercialização mediante solicitação.
Q7. Nos EUA, as alegações de clareamento da pele são consideradas alegações farmacêuticas?
Sim, podem. Alegações que implicam clareamento permanente, alteração do esmalte ou efeitos terapêuticos frequentemente desencadeiam uma análise rigorosa, comparável à de medicamentos.
Q8. Uma Pessoa Responsável da UE também pode gerir os mercados do CCG?
Não. Os mercados do CCG exigem processos de registo e conformidade locais distintos; um RP da UE não abrange automaticamente as obrigações regulamentares do Médio Oriente.
CTA final: Lista de verificação de conformidade (PDF)
Evite atrasos em auditorias, custos de reetiquetagem e retenções alfandegárias.
Baixe nosso Checklist de Cuidados Bucais em PDF ou fale diretamente com um profissional. Especialista em conformidade com OEM Para validar sua documentação antes do lançamento.






