Introduktion
Den här guiden är skriven för inköpschefer, varumärkesgrundare och compliance-ansvariga som köper in tandkräm, munskölj och vitare produkter och som ansvarar för att få munvårdsprodukter godkända och utplacerade på hyllorna. Granskningar och efterlevnad av munvårdsprodukter är de främsta orsakerna till lanseringsförseningar, tullstopp, ommärkningskostnader och misslyckad onboarding i detaljhandeln – inte formuleringskvaliteten.

Munvårdsansikten strängare granskning än allmän kosmetika på grund av aktiva ingredienser, påståenden och spårbarhet av batcher, och en 4-veckors tullperiod kan fånga sexsiffriga MOQ-pengar. Den här artikeln bryter ner region-för-region revisionslogik, munvårdsspecifika krav och tydliga OEM- kontra importörsansvar.
På Oralabx, vi arbetar med varumärken specifikt vid denna bristningspunkt – där formuleringen kan vara redo, men efterlevnaden avgör om en SKU faktiskt når marknaden.
Hur munvårdsrevisioner faktiskt fungerar (obligatoriskt kontra valfritt)
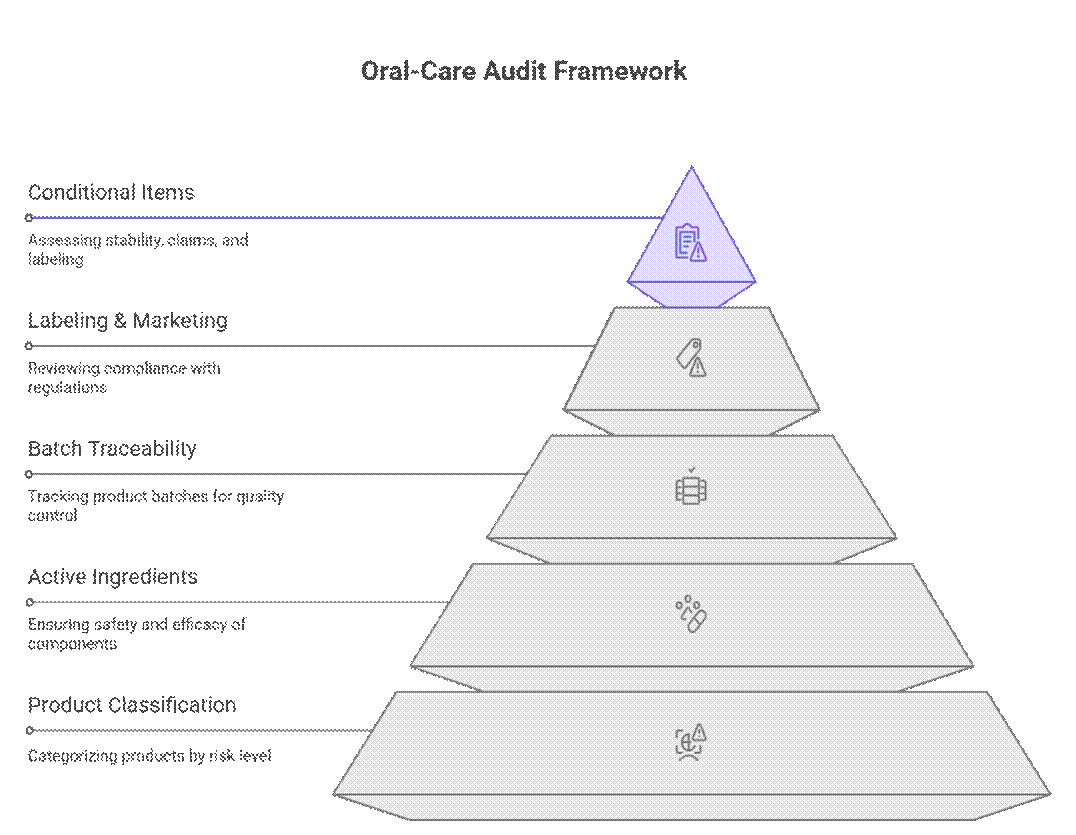
Tillsynsmyndigheter hanterar granskningar och efterlevnad av munvårdsprodukter med hjälp av ett nivåindelat, riskbaserat ramverk som prioriterar produktklassificering, aktiva ingredienser och spårbarhet av batcher före märkning eller marknadsföringsgranskning. Först efter att dessa har godkänts granskar de villkorliga punkter som stabilitetsvaraktighet, bevis på påståenden eller övergångsmärkning.
Vad revisorer kontrollerar först (ej förhandlingsbart)
Revisorer börjar med en strikt uppsättning krav som måste vara uppfyllda innan ytterligare granskning kan fortsätta.
- Produktklassificering (kosmetika vs. receptfria/kvasiläkemedel)
Felklassificering är fortfarande ett av de vanligaste misslyckandena i granskningskraven för tandkräm, särskilt när varumärken missförstår tröskelvärden för klassificering av munvårdsprodukter, kosmetika kontra receptfria produkter, kopplade till aktiva ingredienser och påståenden.
- Tröskelvärden för aktiva ingredienser
Verifierar efterlevnaden av gränsvärden för ingredienser som fluorid eller CPC, vilket kan utlösa tillsyn på receptfri eller läkemedelsnivå.
- Tillverkarens registrering och GMP-status
Säkerställer att OEM-anläggningen är korrekt registrerad och arbetar enligt godkända GMP-standarder för produktion av munvård.
- Batchspårbarhet och återkallelseberedskap
Bekräftar att fullständiga batchregister finns för att snabbt spåra, isolera och återkalla produkter om det krävs av tillsynsmyndigheter eller återförsäljare.
Vad som är villkorligt obligatoriskt
Utöver de icke-förhandlingsbara aspekterna tillämpar revisorer en riskbaserad granskning av dokumentation och testning. Tillämpningen varierar beroende på marknads- och produktrisk, men brister leder ofta till förseningar eller villkorade godkännanden.
- Stabilitetsvaraktighet (accelererad vs. realtid)
Accelererad stabilitet kan vara tillräckligt för tidiga lanseringar eller lanseringar med låg risk, men realtidsstabilitet krävs ofta för produkter med aktiva ingredienser, längre hållbarhet eller striktare marknader som EU eller GCC. Starka OEM-tillverkare kör realtidsstabilitet parallellt.
- Påståendets underbyggande djup
Grundläggande kosmetiska påståenden kräver vanligtvis minimal motivering, medan prestandapåståenden kräver laboratorie- eller kliniska data. Revisorer flaggar påståenden som saknar bevis eller inte överensstämmer med den slutliga formuleringen.
- Lokalt språk och etikettformat
Engelska etiketter kan fungera för granskning, men slutgiltigt godkännande kräver vanligtvis märkning på det lokala språket som uppfyller kraven. Revisorer flaggar ofta saknade underetiketter, felaktiga ingrediensnamn eller riskabla översättningar av påståenden.
Vad är förhandlingsbart (med en stark OEM)
Även om regleringar verkar rigida, inser erfarna revisorer praktiska tillverkningsförhållanden. Med en beprövad OEM och en tydlig färdplan för efterlevnad kan vissa krav fasas eller sekvenseras utan att marknadsinträde hindras.

- Övergångsmärkning
Revisorer kan acceptera interimsmärkning för tidiga körningar om det slutliga konstruktionsarbetet är godkänt och schemalagt. Starka OEM-tillverkare tillämpar batchsegregering och förhindrar att icke-slutgiltiga etiketter kommer in i detaljhandeln.
- Etappvis dokumentation under uppskalning
Revisorer kan acceptera interimsmärkning för tidiga körningar om det slutliga konstruktionsarbetet är godkänt och schemalagt. Starka OEM-tillverkare tillämpar batchsegregering och förhindrar att icke-slutgiltiga etiketter kommer in i detaljhandeln.
- Parallell testning under pilotkörningar
Starka OEM-tillverkare kör stabilitets-, mikrobiella och förpackningstester under pilotbatcher, vilket minskar lanseringstidslinjerna med veckor eller månader.
Visuell platshållare #1: Hierarki för revisionskrav (Munvårdsprodukter)
| Revisionsprioritetsnivå | Kravkategori | Vad detta inkluderar | Revisionspåverkan om den saknas |
| Nivå 1 — Ej förhandlingsbar | Produktklassificering | Bestämning av kosmetiska läkemedel kontra receptfria läkemedel/kvasiläkemedel, tröskelvärden för aktiva ingredienser | Omedelbart revisionsmisslyckande eller tullspärr |
| GMP och anläggningsstatus | ISO 22716, FDA-registrering, hygienkontroller | Avslag på leverans, diskvalificering från fabrik | |
| Batchspårbarhet | Batchregister, återkallelseberedskap, partikodning | Obligatorisk korrigerande åtgärd, potentiell återkallelse | |
| Nivå 2 — Villkorligt obligatoriskt | Stabilitetsstöd | Accelererad och/eller realtidsstabilitet kopplad till hållbarhet | Villkorligt godkännande, skyldighet efter marknadsföring |
| Påståendebevis | Data som stöder påståenden om vitgörande, fluorid, plack och CPC | Borttagning eller ommärkning av anspråk krävs | |
| Lokal märkningsefterlevnad | Språk, format, namngivningskonventioner för ingredienser | Kostnader för ommärkning, försening av lansering | |
| Nivå 3 — Förhandlingsbar (OEM-beroende) | Övergångsmärkning | Interimskonstverk med godkända slutversioner arkiverade | Godkänd med dokumenterad solnedgångsplan |
| Etappvis dokumentation | Uppskjutna långtidstest under uppskalning | Godkänns om riskbedömt och schemalagt | |
| Parallell testning | Stabilitets- och mikrobiella tester under pilotkörningar | Accepterad med starka batchkontroller |
OEM-översikt:
Varumärken misslyckas med revisioner genom att behandla nivå 2- och nivå 3-punkter som valfria gissningar istället för hanterade risker. En stark OEM kontrollerar denna hierarki proaktivt.
Munvård – Specifika granskningspunkter Varumärken Missar
De flesta misslyckade granskningar av munvård orsakas inte av saknade certifikat. De inträffar när varumärken tillämpar allmänna kosmetiska antaganden på produkter med högre risk med aktiva ingredienser, funktionella påståenden och daglig användning.

Revisorer fokuserar tidigt på dessa munvårdsspecifika detaljer, och brister leder ofta till förseningar, ommärkning eller korrigerande åtgärder.
Granskningspunkter specifika för tandkräm
Tandkräm granskas mer aggressivt på grund av påståenden i aktiv och terapeutisk stil.
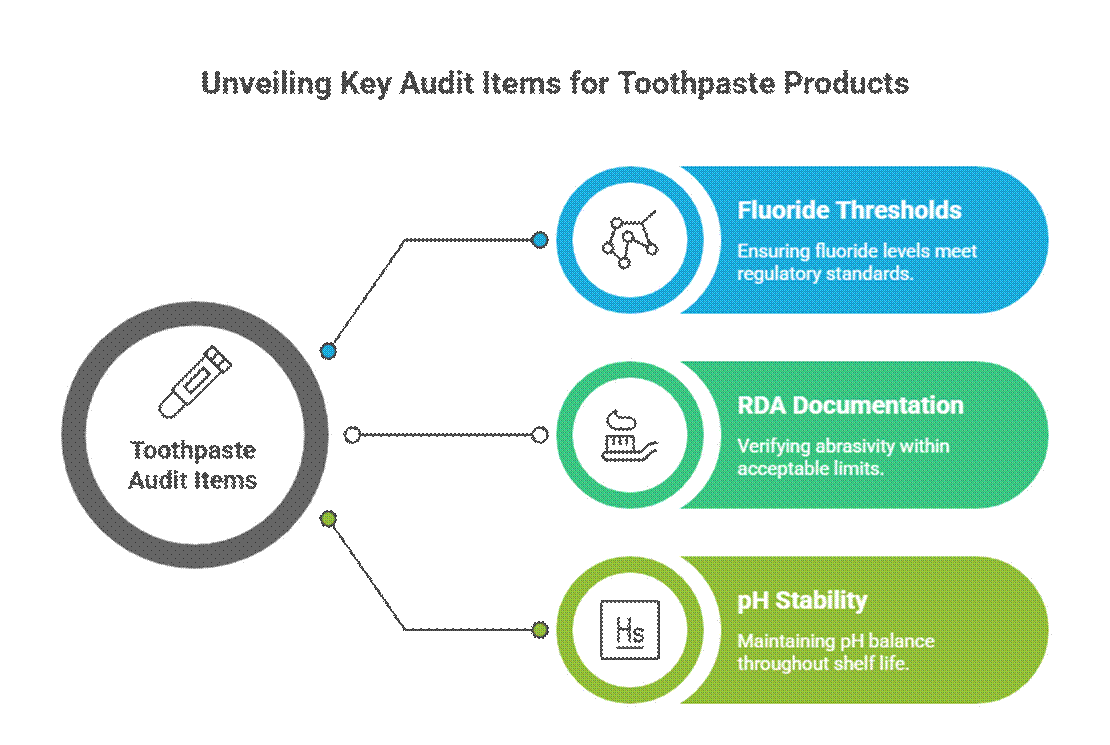
- Fluortrösklar (relevans för FDA-monografi)
I USA, fluortandkräm måste följa FDA:s monografi för fluortandkräm, inklusive aktiv koncentration, märkningsformat och överensstämmelse med påståenden. Revisorer förväntar sig också RDA-dokumentation för tandkräm och validerade krav på stabilitetstestning av munvård under hela hållbarhetstiden.
- RDA-dokumentation (nötningsgränser)
Revisorer förväntar sig att data om relativ dentinslipförmåga (RDA) bekräftar emaljens säkerhet. Saknade eller för höga RDA-värden är en vanlig varningssignal, särskilt för blekning eller formuleringar med träkol.
- pH-stabilitet över hållbarhetstiden
Tandkrämens pH-värde måste ligga inom ett säkert, funktionellt intervall under hela hållbarhetstiden. Revisorer granskar stabilitetsdata för att säkerställa att pH-förskjutningen inte äventyrar fluoridens effektivitet eller orala säkerhet.
Munsköljspecifika granskningspunkter
Granskningar av efterlevnaden av munsköljmedel fokusera starkt på mikrobiell kontroll och aktiv koncentration, särskilt för formler som kräver dokumentation för överensstämmelse med CPC-kraven för munskölj och tester av konserveringsmedelseffektivitet.
- Klassificeringar av alkoholfria kontra alkoholhaltiga
Tandkräm granskas mer aggressivt på grund av påståenden i aktiv och terapeutisk stil.
- CPC %-dokumentation
Revisorer kontrollerar koncentrationsgränser och överensstämmer med påståenden för CPC-innehållande formler.
- Rapporter om mikrobiella utmaningstester
Saknade eller föråldrade utmaningstester leder ofta till villkorliga godkännanden.
- Testning av konserveringsmedelseffektivitet
Svaga konserveringssystem behandlas som produktsäkerhetsrisker.
Varningssignaler för vitare produkter
Revisorer granskar noggrant påståenden om vitgörande tandkrämer, särskilt språkbruk som antyder emaljmodifiering, permanent vitgörande behandling eller terapeutiska resultat som kan utlösa tillsyn på läkemedelsnivå.

- Påståenden om blekning kontra påståenden om läkemedel (USA)
Påståenden som antyder förändringar av emaljen eller terapeutiska resultat kan utlösa läkemedelsklassificering.
- Upplysningar om peroxid/icke-peroxid
Revisorer kräver tydlig redovisning av vitare ingredienser och koncentrationer.
- Påståendeformulering som utlöser myndighetsprövning
Revisorer kräver tydlig redovisning av vitare ingredienser och koncentrationer.
OEM-översikt:
Munvårdsrevisioner misslyckas på aktiva ingredienser och påståenden, inte på förpackningens estetik.
Uppmaning till efterlevnad i mitten av artikeln #1: Ladda ner exempelpaket för efterlevnad
Granska anonymiserad, revisionsklar OEM-dokumentation innan du bestämmer dig för MOQ eller slutför en marknadslansering.
Regionala revisionsramverk (utförandefokuserade)
Revisioner varierar beroende på region, men logiken är konsekvent: tillsynsmyndigheter bedömer produktrisker först, dokumentation sedan och märkning sist. Det som skiljer sig åt är var verkställigheten sker.
USA — FDA och MoCRA
Den amerikanska verkställigheten fokuserar alltmer på FDA:s krav på granskning av munvård, med MoCRA-efterlevnad av munvårdsregler utökat ansvarsskyldighet efter marknaden för varumärken inom munvård.
- Beslutsträd för kosmetika kontra receptfria läkemedel
Felklassificering är en vanlig orsak till verkställighet.
- Anläggningsregistrering och produktlistning
Revisorer verifierar MoCRA-registreringens noggrannhet och SKU-anpassning.
- Batchregister och beredskap för biverkningar
Varumärken måste visa spårbarhet och system för hantering av klagomål.
- Vitgörande påståenden: där varumärken går över gränsen
Överdrivna påståenden om vitgörande medel utlöser ofta granskning av läkemedel.
Europeiska unionen — CPNP och PIF
Efterlevnad av EU:s munvårdsprodukter via CPNP och PIF kräver fullständig överensstämmelse mellan formulering, märkning och CPSR-krav för munvårdsprodukter, där ansvaret vilar på den ansvariga personen.

- Rollen som ansvarig person (RP)
RP måste kontrollera och ha tillgång till hela produktinformationsfilen.
- Förväntningar på säkerhetsbedömning
Generiska CPSR-preparat avvisas ofta för munvårdsprodukter.
- Stabilitets-, CPSR- och märkningskontroller
Inkonsekvenser mellan dokument är vanliga felpunkter.
- Importörsansvarsrisk
Ansvaret ligger hos RP:n eller importören, inte OEM:n.
Mellanöstern — GSO 1943
GSO 1943 registrering för munvård sätter tullen press på att verkställa bestämmelserna, vilket gör märkningens noggrannhet och enhetlighet i inlämningen avgörande för klarering av försändelser.
- Tidslinjer för produktregistrering
Ofullständiga inlämningar återställer ofta processen.
- Arabiska märkningskrav
Saknade eller felaktiga arabiska underetiketter orsakar ofta försändelser.
- Vanliga orsaker till tullbeslag
Ändringar av etiketter efter inlämning och avvikelser i dokumentation.
Mikrofall: EU-tullspärr orsakad av dokumentavvikelse
En europeisk distributör importerade en fluorvitande tandkräm tillverkad av en lågklassig OEM. Även om själva formuleringen uppfyllde kraven stoppades leveransen vid tullen på grund av inkonsekvenser mellan produktinformationsfilen (PIF), stabilitetsdata och slutliga etikettpåståenden. CPSR hänvisade till en tidigare formuleringsversion; stabilitetstester i realtid hade inte initierats och vitningspåståendena översteg vad säkerhetsbedömaren hade godkänt.
Resultatet blev en fyra veckor lång tullperiod, obligatorisk ommärkning och 11 800 euro i oplanerade kostnader – medan lagerkapitalet stod overksamt. Om formuleringsversioner, stabilitetsprotokoll och påståenden hade låsts innan inlämning, skulle leveransen ha klarerats utan ingripande.
Det är därför erfarna OEM-tillverkare av munvårdsprodukter kör parallella stabilitetstester, fryser formuleringsversioner innan PIF slutförs och utför riskgranskningar av reklamationer innan artwork godkänns – vilket förhindrar dokumentationsavvikelser som revisorer omedelbart flaggar.
Ansvarsförtydligande
Stark efterlevnad av GMP-kraven för munvård från OEM, med stöd av ISO 22716-tillverkning av munvårdsprodukter, säkerställer att revisorer kan verifiera spårbarhetskraven för munvårdsprodukter utan korrigerande åtgärder eller återkallelser.
På Oralabx stödjer vi varumärken genom att tydligt separera juridiskt ansvar från utförandestöd – vi tillhandahåller batchspecifik, revisionsklar dokumentation samtidigt som vi flaggar klassificerings- och skaderisker innan de blir verkställighetsproblem.
Importörens kontra OEM-ansvar (avsnitt om tydlighet)
En tydlig ansvarsfördelning är avgörande för att godkännas av munvårdsrevisioner och undvika ansvar efter marknadsföring. Tillsynsmyndigheter bedömer inte "avsikt" eller informella överenskommelser – de bedömer vem som är juridiskt ansvarig och vem som kontrollerar dokumenten. När rollerna är oklara hamnar importören i strid med verkställigheten, även om OEM-tillverkaren utförde de flesta efterlevnadsuppgifterna.
Vad importören är juridiskt ansvarig för
Oavsett OEM-stöd tilldelar tillsynsmyndigheterna det yttersta ansvaret till den part som släpper ut produkten på marknaden. Importörer kan inte lägga ut dessa skyldigheter på entreprenad utan uttrycklig juridisk omfördelning.

- Marknadstillstånd
Säkerställande av juridiskt godkännande före försäljning.
- Godkännande av fordringar
Alla marknadsförings- och förpackningspåståenden faller under importörsansvar.
- Bevaring av dokumentation i detaljhandeln
Importörer måste behålla och uppvisa efterlevnadsdokument på begäran, inklusive åtkomst till PIF, CoA, SDS och register över spårbarhet av batcher.
Vad en kompetent OEM måste tillhandahålla
En kvalificerad OEM-tillverkare av munvårdsprodukter stöder efterlevnaden av reglerna genom att tillhandahålla verifierbar, revisionsklar dokumentation kopplad direkt till varje produktionsbatch.
- GMP-certifiering
Nuvarande, regionsgodkänd GMP-certifiering (t.ex. ISO 22716) som demonstrerar kontrollerad tillverkning, hygien och kvalitetssystem.
- Batchregister och spårbarhet
Kompletta tillverkningsregister för batcher, partikodning och spårbarhet för återkallelser som länkar samman råvaror, produktionsserier och färdiga varor.
- CoA, SDS, stabilitets- och mikrobiella rapporter
Batchspecifika analysintyg, säkerhetsdatablad, stabilitetsstudier och mikrobiella/provokationstestrapporter anpassade till den slutliga formuleringen.
- Exportera dokumentation
Korrekta kommersiella fakturor, packlistor, deklarationer och stödjande exportdokument som överensstämmer med registrerade produktdata och märkning.
Visuell platshållare #2: Tabell över importörs- kontra OEM-ansvar
Denna tabell förtydligar hur tillsynsmyndigheter fördelar ansvar under munvårdsrevisioner och var OEM-stödet slutar och det juridiska ansvaret börjar.
Importörens kontra OEM-ansvar (efterlevnad av munvårdsregler)
| Efterlevnadsområde | Importör (rättsligt ansvar) | OEM (Exekveringsstöd) |
| Produktklassificering | Slutgiltigt klassificeringsbeslut | Formuleringsinmatning och riskflaggor |
| Marknadstillstånd | Registrering, anmälan, RP-möte | Data- och dokumentförberedelse |
| Godkännande av fordringar | Påstående om laglighet och underbyggande | Granskning av skaderisker och datastöd |
| GMP-efterlevnad | Verifierar OEM-kvalificering | Upprätthåller GMP-system och revisioner |
| Batchspårbarhet | Behåller och producerar register | Skapar batchposter och partikodning |
| Stabilitets- och säkerhetsdata | Säkerställer tillräcklighet för marknaden | Utför tester och rapporterar problem |
| Märkningsefterlevnad | Slutgiltigt godkännande av etikett | Granskning av konstverk och formatvägledning |
| Revisionsberedskap för detaljhandeln | Dokumentlagring | Dokumentleverans och uppdateringar |
| Tillämpning och återkallelser | Ekonomiskt och juridiskt ansvar | Tekniskt utredningsstöd |
Viktigt förtydligande:
OEM-tillverkare möjliggör efterlevnad, men importörer absorberar den regulatoriska risken om inte ansvaret omfördelas kontraktuellt. Denna distinktion är central för revisionsresultat och exponering efter marknaden.
Vad en BRA OEM faktiskt gör under en revision
På RUIQIGO, granskningar behandlas inte som dokumenthändelser. Våra OEM-team utformar tillverkningssystem kring regulatoriska kontrollpunkter från dag ett – och integrerar batchspårbarhet, aktiv kontroll och verifiering av efterlevnad direkt i den dagliga produktionen.
OEM-efterlevnadsarbetsflöde (verklig körning)
Under en revision visar kompetenta OEM-tillverkare efterlevnad genom processkontroll, inte reaktivt pappersarbete. Revisorer bedömer om system är inbyggda i den dagliga tillverkningsverksamheten.
- Validering av bänkformulering
Formuleringar valideras i bänkskala för att bekräfta aktiva koncentrationer, pH-intervall och ingredienskompatibilitet före uppskalning.
- Accelererad + realtidsstabilitet
Accelererad stabilitet stöder tidiga inlämningar, medan realtidsstudier körs parallellt för att validera hållbarhet och upptäcka formuleringsavvikelser.
- Skapande av batchark
Varje produktionskörning stöds av batchblad som dokumenterar råvaror, processparametrar, processkontroller och partikoder.
- Mikrobiell och kemisk testning
Färdiga varor genomgår mikrobiell testning och kemisk verifiering för att bekräfta säkerhet, konserveringsmedelsprestanda och överensstämmelse med aktiva ingredienser.
- Utfärdande av CoA
Batchspecifika analysintyg utfärdas och kontrolleras mot specifikationer innan de släpps.
- Export- och tulldokumentation
Fraktdokument, deklarationer och efterlevnadsfiler är anpassade till registrerade produktdata för att förhindra tullavvikelser.
Hur lågnivåtillverkare misslyckas
Revisionsmisslyckanden kan ofta härledas till systemiska svagheter snarare än isolerade misstag. Lågklassiga tillverkare saknar vanligtvis infrastruktur för efterlevnad och agerar bara när problem uppstår.
- Saknar spårbarhet för batcher
Otillräckliga eller inkonsekventa batchregister förhindrar effektiva återkallelser och undergräver omedelbart revisorernas förtroende.
- Återanvändning av generiskt säkerhetsdatablad
Återvunna eller icke-batchspecifika säkerhetsdatabladsfiler signalerar dålig formuleringskontroll och flaggas ofta under revisioner.
- Ingen granskning av skaderisk
Tillverkare som inte bedömer de regulatoriska riskerna kopplade till marknadsföringspåståenden utsätter varumärken för felklassificering och verkställighetsåtgärder.
- Reaktiv (inte proaktiv) efterlevnad
Efterlevnad behandlas som en dokumentförfrågan i sista minuten snarare än ett integrerat tillverkningssystem, vilket leder till förseningar, korrigerande åtgärder och misslyckade revisioner.
OEM-låda för avhämtning:
Brister i efterlevnaden är tillverkningsfel, inte pappersarbete. Revisorer bestraffar svaga system, inte saknade filer.
Uppmaning till uppmaning mitt i artikeln #2: Begär RP/MoCRA-konsultationssamtal
Klargör importörsansvar, produktklassificeringsrisker och dokumentationsbrister med en efterlevnadsspecialist innan du lämnar in eller skickar regulatoriska krav.
Visualiserad tidslinje för revision (valfritt men tydligt)
Tidsplanerna för revisioner varierar beroende på region, men förseningar uppstår konsekvent vid samma tidpunkter – klassificeringsbeslut, ofullständig dokumentation och märkningskorrigeringar i sent skede. Att förstå var tid faktiskt går förlorad gör det möjligt för varumärken att planera lanseringar realistiskt och undvika lagerstopp.

Visuell platshållare #3: Tidslinjediagram för revision (USA vs EU vs Mellanöstern)
Jämförelse av tidslinje för granskning av munvård
| Revisionsfasen | Förenta staterna (FDA / MoCRA) | Europeiska unionen (CPNP / PIF) | Mellanöstern (GSO 1943) |
| Produktklassificering | Beslut om kosmetika kontra receptfria läkemedel | Kosmetisk klassificering | Kosmetisk klassificering |
| Anläggnings-/OEM-kvalificering | Registrering av anläggning | OEM-kvalificering via RP | OEM-datagranskning |
| Säkerhets- och stabilitetsgranskning | Begränsad förmarknad | CPSR + stabilitetsgranskning | Stabilitetsgranskning |
| Granskning av påståenden och märkning | Måttlig | Strikt, förhandsmarknadsföring | Strikt, förhandsmarknadsföring |
| Registrering/anmälan | Produktlista | CPNP-anmälan | Produktregistrering |
| Tull och klarering | Tillämpning efter försäljning | Minimal vid gränsen | Hög efterlevnad |
| Marknadsinträde | Tidig inresa tillåten | Inträde efter godkännande | Inträde efter godkännande |
| Tillämpning efter försäljning | Hög | Måttlig | Låg-Måttlig |
OEM-översikt:
Tid till marknaden komprimeras av parallella arbetsflöden för efterlevnad, inte genom att hoppa över steg.
Slutsats (Kommersiell avslutning)
Långsiktig framgång inom munvård beror på strukturerade system, inte reaktivt pappersarbete. Varumärken som behandlar granskningar och efterlevnad av munvårdsprodukter som en tillverkningsdisciplin, inte en inlämningsuppgift, skyddar marginaler, tidslinjer och återförsäljarnas förtroende. För varumärken som skalar upp tandkräm, munskölj eller vitgörande SKU:er, fungerar Oralabx som en partner för efterlevnadsutförande – och anpassar formulering, dokumentation och batchsystem till granskningsverkligheten i USA, EU och Mellanöstern så att myndighetsgodkännande omvandlas till förutsägbar marknadstillträde.
Vanliga frågor
F1. Vem är juridiskt ansvarig om en munvårdsrevision misslyckas – importör eller OEM?
Importören är juridiskt ansvarig per automatik. OEM-tillverkare kan stödja efterlevnad, men ansvaret ändras endast om det uttryckligen omfördelas genom avtal och accepteras av tillsynsmyndigheter.
F2. Kräver SKU:er för munskölj i enskilda påsar fullständig dokumentation om efterlevnad?
Ja. Påsformat är inte undantagna. Revisorer bedömer formulering, påståenden och säkerhetsdata oavsett förpackningsstorlek.
F3. Kan munsköljprover i enskilda påsar skickas utan säkerhetsdatablad eller äkthetsbevis?
I de flesta fall nej. Prover kan transporteras med begränsade undantag, men säkerhetsdatablad och äkthetsbevis krävs ofta vid tullen, särskilt för flytande munvårdsprodukter.
F4. Hur länge före lanseringen bör efterlevnadsarbetet påbörjas?
Helst 3–6 månader före lansering. Produkter med aktiva ingredienser eller påståenden om vitgörande ingredienser bör påbörja planering för efterlevnad ännu tidigare.
F5. Kräver Amazon-annonser CoA eller SDS?
Amazon begär ofta fram certifieringsbevis, säkerhetsdatablad och efterlevnadsdokument vid godkännande av listning eller revisioner efter listning, särskilt för munvårdsprodukter.
F6. Vilka dokument måste förvaras på återförsäljarnivå?
Återförsäljare behöver vanligtvis tillgång till coA, säkerhetsdatablad, spårbarhetsregister för batcher och bevis på marknadsföringstillstånd på begäran.
F7. Räknas påståenden om vitgörande som påståenden om läkemedel i USA?
Det kan de. Påståenden som antyder permanent blekning, emaljförändring eller terapeutiska effekter utlöser ofta granskning på läkemedelsnivå.
F8. Kan en ansvarig person i EU även hantera GCC-marknader?
Nej. GCC-marknader kräver separata lokala registrerings- och efterlevnadsprocesser; ett EU-registreringsavtal täcker inte automatiskt regleringsskyldigheter i Mellanöstern.
Slutgiltig uppmaning till handling: Checklista för efterlevnad (PDF)
Undvik förseningar i revisioner, kostnader för ommärkning och tullförvaring.
Ladda ner vår checklista för efterlevnad av munvård i PDF-format eller prata direkt med en OEM-efterlevnadsspecialist för att validera din dokumentation före lansering.







