Einführung
Dieser Leitfaden richtet sich an Einkaufsleiter, Markengründer und Compliance-Manager, die Zahnpasta, Mundspülungen und Zahnaufhellungsprodukte beschaffen und für die Zulassung und Markteinführung von Mundpflegeprodukten verantwortlich sind. Produktprüfungen und die Einhaltung von Vorschriften im Bereich Mundpflege sind die Hauptursachen für Verzögerungen bei Markteinführungen, Zollkontrollen, Kosten für die Neuetikettierung und gescheiterte Markteinführung im Einzelhandel – nicht die Qualität der Rezeptur.

Mundpflege-Gesichter Aufgrund der Wirkstoffe, Werbeaussagen und der Chargenrückverfolgbarkeit unterliegen Produkte für die Mundpflege strengeren Kontrollen als allgemeine Kosmetika. Eine vierwöchige Zollabfertigung kann zu einem Verlust von mehreren sechsstelligen Beträgen an Mindestbestellmenge führen. Dieser Artikel erläutert die Prüflogik der einzelnen Regionen, die spezifischen Anforderungen für Mundpflegeprodukte und die klaren Verantwortlichkeiten von Originalherstellern (OEMs) und Importeuren.
Bei Oralabx, Wir arbeiten mit Marken genau an diesem kritischen Punkt zusammen – wo die Rezeptur zwar fertig sein mag, aber die Umsetzung der Compliance-Vorgaben darüber entscheidet, ob ein Produkt tatsächlich auf den Markt kommt.
Wie Mundpflege-Audits tatsächlich funktionieren (obligatorisch vs. optional)
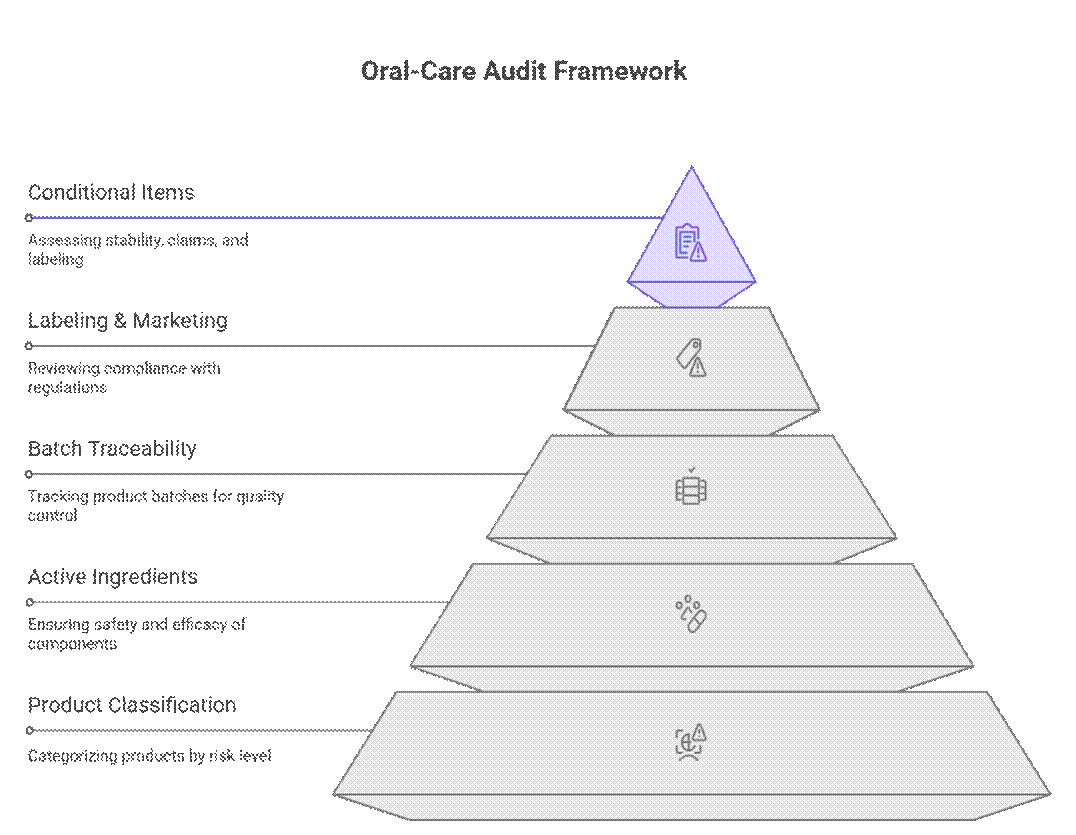
Die Aufsichtsbehörden wenden bei Audits und der Überprüfung der Konformität von Mundpflegeprodukten ein gestuftes, risikobasiertes Verfahren an, das Produktklassifizierung, Wirkstoffe und Chargenrückverfolgbarkeit vor der Kennzeichnungs- oder Vermarktungsprüfung priorisiert. Erst nach deren erfolgreicher Prüfung werden bedingte Kriterien wie Stabilitätsdauer, Nachweisbarkeit von Werbeaussagen oder Übergangskennzeichnungen geprüft.
Was Wirtschaftsprüfer zuerst prüfen (nicht verhandelbar)
Die Prüfer beginnen mit einer Reihe strenger Anforderungen, die erfüllt sein müssen, bevor eine weitere Prüfung erfolgen kann.
- Produktklassifizierung (Kosmetik vs. rezeptfreies Arzneimittel / Quasi-Arzneimittel)
Fehlklassifizierungen gehören nach wie vor zu den häufigsten Fehlern bei der Überprüfung von Zahnpasta, insbesondere wenn Marken die Schwellenwerte für die Klassifizierung von Mundpflegeprodukten als Kosmetikprodukte im Vergleich zu rezeptfreien Produkten in Bezug auf Wirkstoffe und Werbeaussagen falsch verstehen.
- Schwellenwerte für Wirkstoffe
Überprüft die Einhaltung der Grenzwerte für Inhaltsstoffe wie Fluorid oder CPC, die eine Überwachung auf OTC- oder Arzneimittelebene auslösen können.
- Herstellerregistrierung und GMP-Status
Stellt sicher, dass die OEM-Anlage ordnungsgemäß registriert ist und gemäß den genehmigten GMP-Standards arbeitet. Mundpflegeprodukte.
- Chargenrückverfolgbarkeit und Rückrufbereitschaft
Es wird bestätigt, dass vollständige Chargenprotokolle vorhanden sind, um Produkte bei Bedarf von Aufsichtsbehörden oder Einzelhändlern schnell zurückzuverfolgen, zu isolieren und zurückzurufen.
Was ist bedingt erforderlich?
Über die unabdingbaren Kriterien hinaus führen die Prüfer eine risikobasierte Überprüfung der Dokumentation und der Tests durch. Die Durchsetzung variiert je nach Markt und Produktrisiko, doch Lücken führen häufig zu Verzögerungen oder bedingten Genehmigungen.
- Stabilitätsdauer (beschleunigt vs. Echtzeit)
Beschleunigte Stabilitätsprüfungen mögen für frühe oder risikoarme Markteinführungen ausreichend sein, doch Echtzeitstabilität ist häufig für Produkte mit Wirkstoffen, längerer Haltbarkeit oder für strengere Märkte wie die EU oder den Golf-Kooperationsrat (GCC) erforderlich. Etablierte OEMs betreiben daher parallel Echtzeitstabilitätsprüfungen.
- Tiefe der Behauptungsbegründung
Grundlegende kosmetische Aussagen benötigen in der Regel nur eine minimale Begründung, während Leistungsversprechen Labor- oder klinische Daten erfordern. Prüfer kennzeichnen Aussagen, denen Belege fehlen oder die nicht mit der endgültigen Rezeptur übereinstimmen.
- Lokale Sprach- und Beschriftungsformate
Englische Etiketten mögen für die Überprüfung ausreichen, die endgültige Genehmigung erfordert jedoch in der Regel eine konforme Kennzeichnung in der jeweiligen Landessprache. Prüfer bemängeln häufig fehlende Unteretiketten, falsche Zutatenbezeichnungen oder riskante Übersetzungen von Werbeaussagen.
Was ist verhandelbar (mit einem starken OEM)
Auch wenn Vorschriften starr erscheinen, berücksichtigen erfahrene Auditoren die praktischen Gegebenheiten der Fertigung. Mit einem bewährten OEM und einem klaren Compliance-Plan lassen sich einige Anforderungen schrittweise oder nacheinander umsetzen, ohne den Marktzugang zu blockieren.

- Übergangsbezeichnung
Prüfer können vorläufige Etiketten für frühe Produktionsläufe akzeptieren, sofern das endgültige Design freigegeben und terminiert ist. Strenge OEMs achten auf die Trennung der Chargen und verhindern, dass nicht finale Etiketten in den Handel gelangen.
- Stufenweise Dokumentation während der Skalierung
Prüfer können vorläufige Etiketten für frühe Produktionsläufe akzeptieren, sofern das endgültige Design freigegeben und terminiert ist. Strenge OEMs achten auf die Trennung der Chargen und verhindern, dass nicht finale Etiketten in den Handel gelangen.
- Paralleltests während der Pilotläufe
Starke OEMs führen Stabilitäts-, mikrobiologische und Verpackungstests bereits während der Pilotchargen durch und verkürzen so die Markteinführungszeit um Wochen oder Monate.
Visueller Platzhalter #1: Hierarchie der Auditanforderungen (Mundpflegeprodukte)
| Prioritätsstufe der Prüfung | Anforderungskategorie | Was dies beinhaltet | Auswirkungen auf die Prüfung bei Fehlen |
| Stufe 1 – Nicht verhandelbar | Produktklassifizierung | Kosmetik vs. OTC / Quasi-Arzneimittelbestimmung, Wirkstoffschwellenwerte | Sofortiges Scheitern der Prüfung oder Zollbeschlagnahme |
| GMP- und Anlagenstatus | ISO 22716, FDA-Registrierung, Hygienekontrollen | Ablehnung der Lieferung, Disqualifizierung des Werks | |
| Chargenrückverfolgbarkeit | Chargenprotokolle, Rückrufbereitschaft, Chargencodierung | Obligatorische Korrekturmaßnahmen, möglicher Rückruf | |
| Stufe 2 – Bedingt erforderlich | Stabilitätsunterstützung | Beschleunigte und/oder Echtzeit-Stabilität in Verbindung mit der Haltbarkeit | Bedingte Zulassung, Verpflichtung nach Markteinführung |
| Begründung der Behauptung | Daten, die Behauptungen zu Zahnaufhellung, Fluorid, Plaque und CPC stützen | Entfernung oder Neuetikettierung der Ansprüche erforderlich | |
| Einhaltung der lokalen Kennzeichnungsvorschriften | Sprache, Format, Namenskonventionen für Zutaten | Kosten für die Neuetikettierung, Verzögerung der Markteinführung | |
| Stufe 3 – Verhandelbar (Herstellerabhängig) | Übergangsbezeichnung | Vorläufige Entwürfe mit genehmigten Endfassungen sind in der Akte vorhanden. | Akzeptiert mit dokumentiertem Auslaufplan |
| Stufenweise Dokumentation | Aufgeschobene Langzeittests während der Skalierung | Akzeptiert, sofern eine Risikobewertung durchgeführt und ein Zeitplan erstellt wurde. | |
| Paralleltests | Stabilitäts- und mikrobiologische Tests während der Pilotläufe | Akzeptiert bei strengen Chargenkontrollen |
Fazit für den Hersteller:
Marken scheitern an Audits, wenn sie die Punkte der Stufen 2 und 3 als optionale Schätzungen statt als kalkuliertes Risiko behandeln. Ein starker OEM steuert diese Hierarchie proaktiv.
Mundpflegespezifische Prüfpunkte, die Marken versäumen
Die meisten Mängel bei Audits im Bereich Mundpflegeprodukte sind nicht auf fehlende Zertifikate zurückzuführen. Sie treten vielmehr dann auf, wenn Marken allgemeine kosmetische Annahmen auf risikoreichere Produkte mit Wirkstoffen, funktionellen Aussagen und täglicher Anwendung anwenden.

Die Prüfer achten frühzeitig auf diese mundpflegespezifischen Details, und Lücken führen oft zu Verzögerungen, Neuetikettierungen oder Korrekturmaßnahmen.
Prüfpunkte speziell für Zahnpasta
Zahnpasta wird aufgrund von Werbeaussagen mit aktiver und therapeutischer Wirkung strenger geprüft.
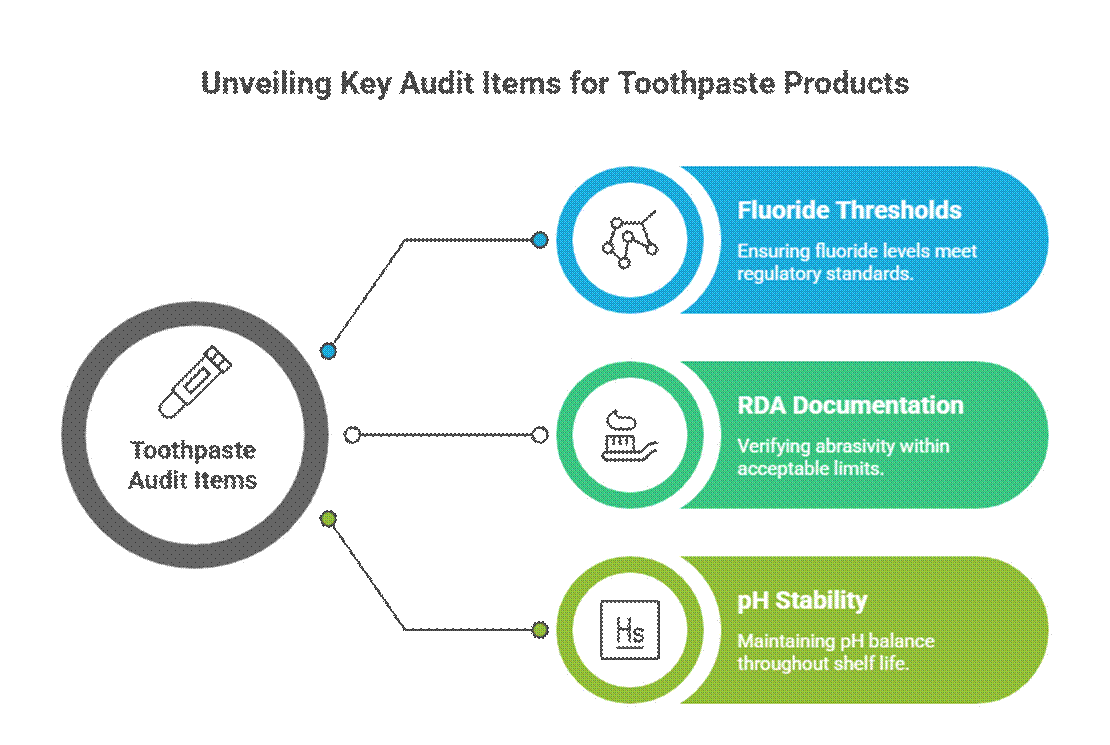
- Fluoridgrenzwerte (Relevanz der FDA-Monographie)
In den USA, Fluorid-Zahnpasta Die Zahnpasta muss den Vorgaben der FDA-Monographie für Fluoridzahnpasta entsprechen, einschließlich Wirkstoffkonzentration, Kennzeichnungsformat und Übereinstimmung der Werbeaussagen. Die Prüfer erwarten außerdem die Dokumentation der empfohlenen Verwendungszweckvorgaben (RDA) für Zahnpasta sowie den Nachweis validierter Stabilitätsprüfungen für Mundpflegeprodukte über die gesamte Haltbarkeitsdauer.
- RDA-Dokumentation (Abrasivitätsgrenzen)
Prüfer erwarten Daten zur relativen Dentinabrasivität (RDA), um die Sicherheit des Zahnschmelzes zu bestätigen. Fehlende oder zu hohe RDA-Werte sind ein häufiges Warnsignal, insbesondere bei Zahnaufhellungs- oder Aktivkohlepräparaten.
- pH-Stabilität während der Haltbarkeitsdauer
Der pH-Wert der Zahnpasta muss während der gesamten Haltbarkeitsdauer in einem sicheren, funktionellen Bereich bleiben. Prüfer kontrollieren die Stabilitätsdaten, um sicherzustellen, dass pH-Wert-Schwankungen die Wirksamkeit des Fluorids oder die Mundgesundheit nicht beeinträchtigen.
Spezifische Prüfpunkte für Mundspülungen
Audits zur Einhaltung der Mundspülungsvorschriften Besonderes Augenmerk sollte auf die mikrobielle Kontrolle und die Wirkstoffkonzentration gelegt werden, insbesondere bei Rezepturen, die eine Dokumentation zur Einhaltung der CPC-Mundspülungsvorschriften und eine Prüfung der Konservierungsmittelwirksamkeit erfordern.
- Klassifizierungen: alkoholfrei vs. alkoholhaltig
Zahnpasta wird aufgrund von Werbeaussagen mit aktiver und therapeutischer Wirkung strenger geprüft.
- CPC %-Dokumentation
Die Prüfer kontrollieren die Konzentrationsgrenzwerte und die Einhaltung der Vorschriften für CPC-haltige Formeln.
- Berichte über mikrobielle Belastungstests
Fehlende oder veraltete Sicherheitsprüfungen führen häufig zu bedingten Zulassungen.
- Prüfung der Konservierungsmittelwirksamkeit
Schwache Konservierungssysteme werden als Produktsicherheitsrisiko betrachtet.
Warnsignale bei Aufhellungsprodukten
Die Prüfer untersuchen die regulatorischen Angaben zu aufhellenden Zahnpasten genau, insbesondere Formulierungen, die auf eine Veränderung des Zahnschmelzes, eine dauerhafte Aufhellung oder therapeutische Ergebnisse hindeuten und eine Überwachung auf Arzneimittelebene auslösen können.

- Aussagen zur Hautaufhellung vs. Aussagen zu Arzneimitteln (USA)
Aussagen, die eine Veränderung des Zahnschmelzes oder therapeutische Ergebnisse implizieren, können eine Arzneimittelklassifizierung auslösen.
- Offenlegung von Peroxid- und Nicht-Peroxid-Produkten
Die Prüfer verlangen eine klare Offenlegung der verwendeten Bleichmittel und ihrer Konzentrationen.
- Aussagenformulierung, die eine behördliche Überprüfung auslöst
Die Prüfer verlangen eine klare Offenlegung der verwendeten Bleichmittel und ihrer Konzentrationen.
Fazit für den Hersteller:
Audits im Bereich der Mundpflege scheitern an den Wirkstoffen und den Werbeaussagen, nicht an der Ästhetik der Verpackung.
Mitte des Artikels CTA #1: Beispielhaftes Compliance-Paket herunterladen
Prüfen Sie anonymisierte, revisionssichere OEM-Dokumentationen, bevor Sie eine Mindestbestellmenge festlegen oder eine Markteinführung finalisieren.
Regionale Prüfungsrahmen (umsetzungsorientiert)
Die Prüfungen variieren je nach Region, die Logik ist jedoch dieselbe: Die Aufsichtsbehörden bewerten zuerst das Produktrisiko, dann die Dokumentation und zuletzt die Kennzeichnung. Unterschiedlich ist jedoch, wo die Durchsetzung erfolgt.
Vereinigte Staaten – FDA & MoCRA
Die US-Durchsetzung konzentriert sich zunehmend auf die Anforderungen der FDA an die Mundpflege-Audits, mit Einhaltung der MoCRA-Richtlinien zur Mundpflege Ausweitung der Verantwortung nach der Markteinführung für Mundpflegeprodukte.
- Entscheidungsbaum für Kosmetikprodukte vs. rezeptfreie Produkte
Fehlklassifizierung ist ein häufiger Auslöser für behördliche Maßnahmen.
- Anlagenregistrierung & Produktliste
Die Prüfer überprüfen die Genauigkeit der MoCRA-Registrierung und die Übereinstimmung der Artikelnummern.
- Chargenprotokolle und Bereitschaft zu unerwünschten Ereignissen
Marken müssen Systeme zur Rückverfolgbarkeit und zum Beschwerdemanagement nachweisen.
- Aufhellungsversprechen: Wo Marken die Grenze überschreiten
Überzogene Werbeversprechen zur Hautaufhellung führen oft zu polizeilichen Überprüfungen des Arzneimittels.
Europäische Union – CPNP & PIF
Die Einhaltung der EU-Vorschriften für Mundpflegeprodukte durch CPNP und PIF erfordert eine vollständige Angleichung der Anforderungen an Rezeptur, Kennzeichnung und CPSR für Mundpflegeprodukte, wobei die Haftung bei der verantwortlichen Person liegt.

- Rolle der verantwortlichen Person (RP)
Der RP muss die vollständige Produktinformationsdatei kontrollieren und darauf zugreifen können.
- Erwartungen an die Sicherheitsbewertung
Generische CPSRs werden häufig für Mundpflegeprodukte abgelehnt.
- Stabilitäts-, CPSR- und Kennzeichnungsprüfungen
Inkonsistenzen zwischen verschiedenen Dokumenten sind häufige Fehlerquellen.
- Haftungsrisiko des Importeurs
Die Haftung liegt beim Wiederverkäufer bzw. Importeur, nicht beim Originalhersteller.
Naher Osten — GSO 1943
GSO 1943 Registrierung für Mundpflege Dies setzt die Zollbehörden unter Druck, wodurch die Genauigkeit der Kennzeichnung und die Konsistenz der Angaben für die Zollabfertigung von entscheidender Bedeutung sind.
- Zeitpläne für die Produktregistrierung
Unvollständige Einreichungen setzen den Prozess oft zurück.
- Arabische Kennzeichnungsvorschriften
Fehlende oder fehlerhafte arabische Unteretiketten führen häufig zu Verzögerungen bei der Sendungsverfolgung.
- Häufige Gründe für Beschlagnahmungen durch den Zoll
Änderungen der Etiketten nach der Einreichung und Dokumentationsabweichungen.
Mikro-Fallbeispiel: EU-Zollsperre aufgrund mangelhafter Dokumentation
Ein europäischer Händler importierte eine fluoridhaltige Zahnaufhellungscreme eines kleineren Herstellers. Obwohl die Rezeptur selbst den Vorschriften entsprach, wurde die Sendung vom Zoll aufgrund von Unstimmigkeiten zwischen den Produktinformationen, den Stabilitätsdaten und den Angaben auf dem Etikett gestoppt. Die CPSR bezog sich auf eine ältere Rezepturversion; Echtzeit-Stabilitätsstudien waren noch nicht durchgeführt worden, und die Angaben zur Aufhellungswirkung gingen über die vom Sicherheitsgutachter genehmigten Werte hinaus.
Die Folge waren ein vierwöchiger Zollstopp, eine obligatorische Neuetikettierung und ungeplante Kosten in Höhe von 11.800 € – während das Lagerkapital ungenutzt blieb. Wären die Rezeptur, die Stabilitätsprotokolle und die Nachweise für die Werbeaussagen vor der Einreichung finalisiert gewesen, hätte die Sendung ohne weitere Maßnahmen abgefertigt werden können.
Aus diesem Grund führen erfahrene OEMs im Bereich der Mundpflegeprodukte parallele Stabilitätsprüfungen durch, frieren Formulierungsversionen vor der endgültigen Fertigstellung des PIF ein und führen Risikobewertungen der Werbeaussagen vor der Genehmigung der Druckvorlage durch – um Abweichungen in der Dokumentation zu vermeiden, die von den Prüfern sofort beanstandet werden.
Verantwortlichkeitsklärung
Eine hohe GMP-Konformität der OEMs im Bereich der Mundpflegeprodukte, unterstützt durch die ISO 22716-Norm für die Herstellung von Mundpflegeprodukten, gewährleistet, dass die Prüfer die Anforderungen an die Chargenrückverfolgbarkeit von Mundpflegeprodukten ohne Korrekturmaßnahmen oder Rückrufe überprüfen können.
Bei Oralabx unterstützen wir Marken, indem wir die rechtliche Verantwortung klar von der Umsetzungsunterstützung trennen – wir liefern chargenspezifische, revisionssichere Dokumentationen und weisen auf Klassifizierungs- und Schadensrisiken hin, bevor diese zu Durchsetzungsproblemen werden.
Verantwortung des Importeurs vs. des Originalherstellers (Klarstellungsabschnitt)
Eine klare Trennung der Verantwortlichkeiten ist unerlässlich, um Audits im Bereich der Mundpflegeprodukte erfolgreich zu bestehen und Haftungsansprüche nach der Markteinführung zu vermeiden. Die Aufsichtsbehörden bewerten weder “Absichten” noch informelle Absprachen, sondern prüfen, wer rechtlich verantwortlich ist und wer die Dokumente kontrolliert. Sind die Rollen unklar, fällt die Durchsetzung der Vorschriften standardmäßig an den Importeur, selbst wenn der Originalhersteller (OEM) die meisten Compliance-Aufgaben übernommen hat.
Wofür der Importeur rechtlich haftet
Ungeachtet der Unterstützung durch den Originalhersteller (OEM) liegt die letztendliche Verantwortung laut Regulierungsbehörden bei demjenigen, der das Produkt auf den Markt bringt. Importeure können diese Pflichten nicht ohne ausdrückliche rechtliche Übertragung auslagern.

- Marktzulassung
Sicherstellung der rechtlichen Genehmigung vor dem Verkauf.
- Genehmigung von Anträgen
Sämtliche Marketing- und Verpackungsangaben fallen unter die Haftung des Importeurs.
- Aufbewahrung von Einzelhandelsdokumenten
Importeure müssen die Konformitätsdokumente aufbewahren und auf Anfrage vorlegen können, einschließlich PIF-Zugangsdaten, Analysenzertifikate, Sicherheitsdatenblätter und Chargenrückverfolgbarkeitsaufzeichnungen.
Was ein kompetenter OEM bieten muss
Ein qualifizierter OEM für Mundpflegeprodukte unterstützt die Einhaltung der Vorschriften, indem er überprüfbare, auditfähige Dokumentationen liefert, die direkt mit jeder Produktionscharge verknüpft sind.
- GMP-Zertifizierung
Aktuell, regional anerkannte GMP-Zertifizierung (z. B. ISO 22716) Nachweise für kontrollierte Fertigungs-, Hygiene- und Qualitätssysteme.
- Chargenprotokolle und Rückverfolgbarkeit
Vollständige Chargenfertigungsaufzeichnungen, Loscodierung und Rückruf-Rückverfolgbarkeit, die Rohstoffe, Produktionsläufe und Fertigprodukte miteinander verknüpfen.
- Analysezertifikat, Sicherheitsdatenblatt, Stabilitäts- und mikrobiologische Berichte
Chargenspezifische Analysenzertifikate, Sicherheitsdatenblätter, Stabilitätsstudien und mikrobiologische Prüfberichte/Belastungstests, abgestimmt auf die endgültige Formulierung.
- Exportdokumentation
Genaue Handelsrechnungen, Packlisten, Deklarationen und begleitende Exportdokumente, die mit den registrierten Produktdaten und der Kennzeichnung übereinstimmen.
Visueller Platzhalter #2: Tabelle zur Verantwortlichkeit von Importeur und OEM
Diese Tabelle verdeutlicht, wie die Aufsichtsbehörden bei Audits der Mundpflege die Verantwortlichkeiten zuweisen und wo die Unterstützung durch den Originalhersteller endet und die rechtliche Haftung beginnt.
Verantwortung des Importeurs vs. des Originalherstellers (Einhaltung der Mundpflegevorschriften)
| Compliance-Bereich | Importeur (Rechtliche Haftung) | OEM (Ausführungsunterstützung) |
| Produktklassifizierung | Endgültige Klassifizierungsentscheidung | Formulierungseingaben und Risikokennzeichen |
| Marktzulassung | Registrierung, Benachrichtigung, RP-Termin | Daten- und Dokumentenaufbereitung |
| Genehmigung von Anträgen | Rechtmäßigkeit und Untermauerung der Behauptung | Schadenrisikoprüfung und Datenunterstützung |
| GMP-Konformität | Prüft die OEM-Qualifikation | Pflegt GMP-Systeme und führt Audits durch |
| Chargenrückverfolgbarkeit | Speichert und erstellt Aufzeichnungen | Erstellt Chargenprotokolle und Loscodierungen. |
| Stabilitäts- und Sicherheitsdaten | Gewährleistet die Angemessenheit für den Markt | Führt Tests durch und erstellt Berichte |
| Einhaltung der Kennzeichnungsvorschriften | Endgültige Etikettenfreigabe | Überprüfung von Grafiken und Formatvorgaben |
| Bereitschaft für Einzelhandelsaudits | Aufbewahrung von Dokumenten | Dokumentenbereitstellung und -aktualisierungen |
| Durchsetzung & Rückrufe | Finanzielle und rechtliche Verantwortung | Unterstützung bei technischen Untersuchungen |
Wichtigste Klarstellung:
OEMs ermöglichen die Einhaltung der Vorschriften, Importeure tragen jedoch das regulatorische Risiko, sofern die Haftung nicht vertraglich übertragen wird. Diese Unterscheidung ist zentral für die Ergebnisse von Audits und die Risiken nach der Markteinführung.
Was ein guter OEM während eines Audits tatsächlich tut
Bei RUIQIGO, Audits werden nicht als bloße Dokumentationsereignisse behandelt. Unsere OEM-Teams konzipieren Fertigungssysteme von Anfang an unter Berücksichtigung regulatorischer Kontrollpunkte – Chargenrückverfolgbarkeit, aktive Kontrolle und Konformitätsprüfung werden direkt in die tägliche Produktion integriert.
OEM-Konformitäts-Workflow (Reale Umsetzung)
Im Rahmen eines Audits weisen kompetente OEMs die Einhaltung der Vorschriften durch Prozesskontrolle nach, nicht durch reaktive Dokumentation. Die Auditoren beurteilen, ob die Systeme in die täglichen Fertigungsabläufe integriert sind.
- Validierung der Bench-Formulierung
Die Formulierungen werden im Labormaßstab validiert, um die Wirkstoffkonzentrationen, den pH-Bereich und die Kompatibilität der Inhaltsstoffe vor der Produktionsausweitung zu bestätigen.
- Beschleunigte + Echtzeitstabilität
Beschleunigte Stabilitätsprüfungen unterstützen frühe Einreichungen, während parallel Echtzeitstudien durchgeführt werden, um die Haltbarkeit zu validieren und Formulierungsabweichungen zu erkennen.
- Erstellung eines Chargenblatts
Jeder Produktionslauf wird durch Chargenprotokolle unterstützt, die Rohstoffe, Prozessparameter, Prozesskontrollen und Chargencodes dokumentieren.
- Mikrobielle und chemische Tests
Die Fertigprodukte werden mikrobiologischen Tests und chemischen Prüfungen unterzogen, um die Sicherheit, die Wirksamkeit der Konservierungsmittel und die Einhaltung der Wirkstoffvorschriften zu bestätigen.
- CoA-Ausstellung
Chargenspezifische Analysezertifikate werden ausgestellt und vor der Freigabe mit den Spezifikationen abgeglichen.
- Export- und Zolldokumentation
Versanddokumente, Deklarationen und Konformitätsunterlagen werden mit den registrierten Produktdaten abgeglichen, um Zollabweichungen zu vermeiden.
Wie Billighersteller scheitern
Fehler bei Audits lassen sich oft auf systemische Schwächen und nicht auf vereinzelte Fehler zurückführen. Billighersteller typischerweise fehlt es an einer entsprechenden Infrastruktur und sie reagieren erst, wenn Probleme auftreten.
- Fehlende Chargenrückverfolgbarkeit
Unzureichende oder inkonsistente Chargenaufzeichnungen verhindern effektive Rückrufe und untergraben sofort das Vertrauen der Prüfer.
- Wiederverwendung von generischen Sicherheitsdatenblättern
Wiederverwendete oder nicht chargenspezifische Sicherheitsdatenblätter deuten auf eine mangelhafte Rezepturkontrolle hin und werden häufig bei Audits beanstandet.
- Keine Schadensrisikoprüfung
Hersteller, die das mit ihren Marketingaussagen verbundene regulatorische Risiko nicht bewerten, setzen ihre Marken der Gefahr einer Fehlklassifizierung und behördlichen Maßnahmen aus.
- Reaktive (nicht proaktive) Einhaltung
Die Einhaltung von Vorschriften wird wie eine Dokumentenanforderung in letzter Minute behandelt und nicht wie ein integriertes Fertigungssystem, was zu Verzögerungen, Korrekturmaßnahmen und fehlgeschlagenen Audits führt.
OEM-Takeaway-Box:
Verstöße gegen die Compliance-Vorschriften sind Produktionsfehler, keine Dokumentationsprobleme. Prüfer bestrafen schwache Systeme, nicht fehlende Akten.
Mitte des Artikels CTA #2: Anfrage zur RP-/MoCRA-Konsultation
Klären Sie vor der Einreichung bei den Behörden oder dem Versand Fragen zur Importeurshaftung, zu Risiken bei der Produktklassifizierung und zu Dokumentationslücken mit einem Compliance-Spezialisten.
Visualisierter Audit-Zeitplan (optional, aber hilfreich)
Die Bearbeitungszeiten für Audits variieren je nach Region, doch Verzögerungen treten stets an denselben Stellen auf – bei Klassifizierungsentscheidungen, unvollständiger Dokumentation und Korrekturen der Etikettierung in der Endphase. Das Wissen um die tatsächlichen Zeitverluste ermöglicht es Marken, Produkteinführungen realistisch zu planen und Lagerengpässe zu vermeiden.

Visueller Platzhalter #3: Zeitleiste für die Auditierung (USA vs. EU vs. Naher Osten)
Zeitlicher Vergleich der Mundpflege-Audit-Zeitleiste
| Prüfungsphase | Vereinigte Staaten (FDA / MoCRA) | Europäische Union (CPNP / PIF) | Naher Osten (GSO 1943) |
| Produktklassifizierung | Entscheidung zwischen Kosmetik und rezeptfreien Produkten | Kosmetische Klassifizierung | Kosmetische Klassifizierung |
| Anlagen-/OEM-Qualifizierung | Anlagenregistrierung | OEM-Qualifizierung über RP | OEM-Datenanalyse |
| Sicherheits- und Stabilitätsprüfung | Begrenzter Vormarkt | CPSR + Stabilitätsprüfung | Stabilitätsprüfung |
| Überprüfung von Werbeaussagen und Kennzeichnung | Mäßig | Streng, vorbörslich | Streng, vorbörslich |
| Anmeldung/Benachrichtigung | Produktliste | CPNP-Benachrichtigung | Produktregistrierung |
| Zollabfertigung | Durchsetzung nach dem Markteintritt | Minimal an der Grenze | Strenge Durchsetzung |
| Markteintritt | Früher Einlass erlaubt | Zugang nach Genehmigung | Zugang nach Genehmigung |
| Durchsetzung nach dem Markteintritt | Hoch | Mäßig | Niedrig bis mittel |
Fazit für den Hersteller:
Die Markteinführungszeit wird durch parallele Compliance-Workflows verkürzt, nicht durch das Überspringen von Schritten.
Fazit (Kommerzieller Schluss)
Langfristiger Erfolg in der Mundpflege hängt von strukturierten Systemen ab, nicht von reaktivem Papierkram. Marken, die Produktprüfungen und die Einhaltung von Vorschriften im Bereich Mundpflege als integralen Bestandteil der Fertigung und nicht als reine Zulassungsaufgabe betrachten, sichern ihre Margen, halten Termine ein und erhalten das Vertrauen des Handels. Für Marken, die Zahnpasta, Mundspülungen oder Zahnaufhellungsprodukte in größerem Umfang anbieten, agiert Oralabx als Partner für die Umsetzung der Compliance-Vorgaben. Wir passen Rezeptur, Dokumentation und Chargensysteme an die Anforderungen der Prüfungen in den USA, der EU und dem Nahen Osten an, um sicherzustellen, dass die behördliche Zulassung zu einem planbaren Marktzugang führt.
FAQs
Frage 1: Wer haftet rechtlich, wenn ein Audit zur Mundpflege fehlschlägt – der Importeur oder der Originalhersteller?
Der Importeur haftet standardmäßig. OEMs können die Einhaltung der Vorschriften unterstützen, die Haftung verschiebt sich jedoch nur, wenn dies vertraglich ausdrücklich vereinbart und von den Aufsichtsbehörden akzeptiert wird.
Frage 2: Benötigen Mundwasser-Einzelpackungen eine vollständige Konformitätsdokumentation?
Ja. Auch Portionsbeutel sind nicht ausgenommen. Die Prüfer bewerten Zusammensetzung, Werbeaussagen und Sicherheitsdaten unabhängig von der Packungsgröße.
Frage 3: Können Mundwasserproben in Einzelbeuteln ohne Sicherheitsdatenblatt oder Analysezertifikat versendet werden?
In den meisten Fällen nein. Muster können unter bestimmten Ausnahmen versendet werden, aber Sicherheitsdatenblätter und Analysezertifikate werden üblicherweise vom Zoll verlangt, insbesondere für flüssige Mundpflegeprodukte.
Frage 4: Wie lange vor dem Marktstart sollten die Compliance-Arbeiten beginnen?
Idealerweise 3–6 Monate vor der Markteinführung. Bei Produkten mit Wirkstoffen oder aufhellenden Wirkungen sollte die Planung der Einhaltung der Vorschriften sogar noch früher beginnen.
Frage 5: Benötigen Amazon-Angebote ein Analysezertifikat (CoA) oder ein Sicherheitsdatenblatt (SDS)?
Amazon fordert häufig Analysenzertifikate, Sicherheitsdatenblätter und Konformitätsdokumente im Rahmen der Listungsgenehmigung oder nachträglicher Audits an, insbesondere bei Mundpflegeprodukten.
Frage 6: Welche Dokumente müssen auf Händlerebene aufbewahrt werden?
Einzelhändler verlangen in der Regel auf Anfrage Zugang zu Analysenzertifikaten, Sicherheitsdatenblättern, Chargenrückverfolgbarkeitsaufzeichnungen und Nachweisen der Marktzulassung.
Frage 7: Gelten Werbeaussagen zu Zahnaufhellungsprodukten in den USA als Arzneimittelwerbung?
Das können sie. Behauptungen, die eine dauerhafte Aufhellung, eine Veränderung des Zahnschmelzes oder therapeutische Wirkungen implizieren, lösen oft eine genaue Prüfung auf Arzneimittelebene aus.
Frage 8: Kann eine EU-Verantwortliche Person auch für die Märkte des Golf-Kooperationsrats (GCC) zuständig sein?
Nein. Die Märkte des Golf-Kooperationsrats (GCC) erfordern separate lokale Registrierungs- und Compliance-Prozesse; eine EU-Registrierungsstelle deckt nicht automatisch die regulatorischen Verpflichtungen des Nahen Ostens ab.
Abschließende CTA: Checkliste zur Einhaltung der Vorschriften (PDF)
Vermeiden Sie Verzögerungen durch Audits, Kosten für die Neuetikettierung und Zollkontrollen.
Laden Sie unsere PDF-Checkliste zur Einhaltung der Mundpflegevorschriften herunter oder sprechen Sie direkt mit einem/einer Spezialist für OEM-Konformität Um Ihre Dokumentation vor der Veröffentlichung zu überprüfen.