Introduzione
Questa guida è rivolta ai responsabili degli acquisti, ai fondatori di marchi e ai responsabili della conformità che si occupano dell'approvvigionamento di dentifrici, collutori e prodotti sbiancanti, responsabili dell'approvazione e della distribuzione degli SKU per l'igiene orale. Le verifiche e la conformità dei prodotti per l'igiene orale sono le principali cause di ritardi nel lancio, blocchi doganali, costi di rietichettatura e mancata acquisizione da parte dei rivenditori, non la qualità delle formulazioni.

Volti per la cura orale Un controllo più rigoroso rispetto ai cosmetici generici, dovuto a principi attivi, dichiarazioni e tracciabilità dei lotti, e un fermo doganale di 4 settimane può intrappolare quantità di denaro a sei cifre per un minimo d'ordine (MOQ). Questo articolo analizza la logica di audit regione per regione, i requisiti specifici per l'igiene orale e le chiare responsabilità di OEM e importatori.
A Oralabx, lavoriamo con i marchi specificamente in questo momento di fallimento, in cui la formulazione potrebbe essere pronta, ma l'esecuzione della conformità determina se uno SKU raggiunge effettivamente il mercato.
Come funzionano realmente i controlli di igiene orale (obbligatori vs facoltativi)
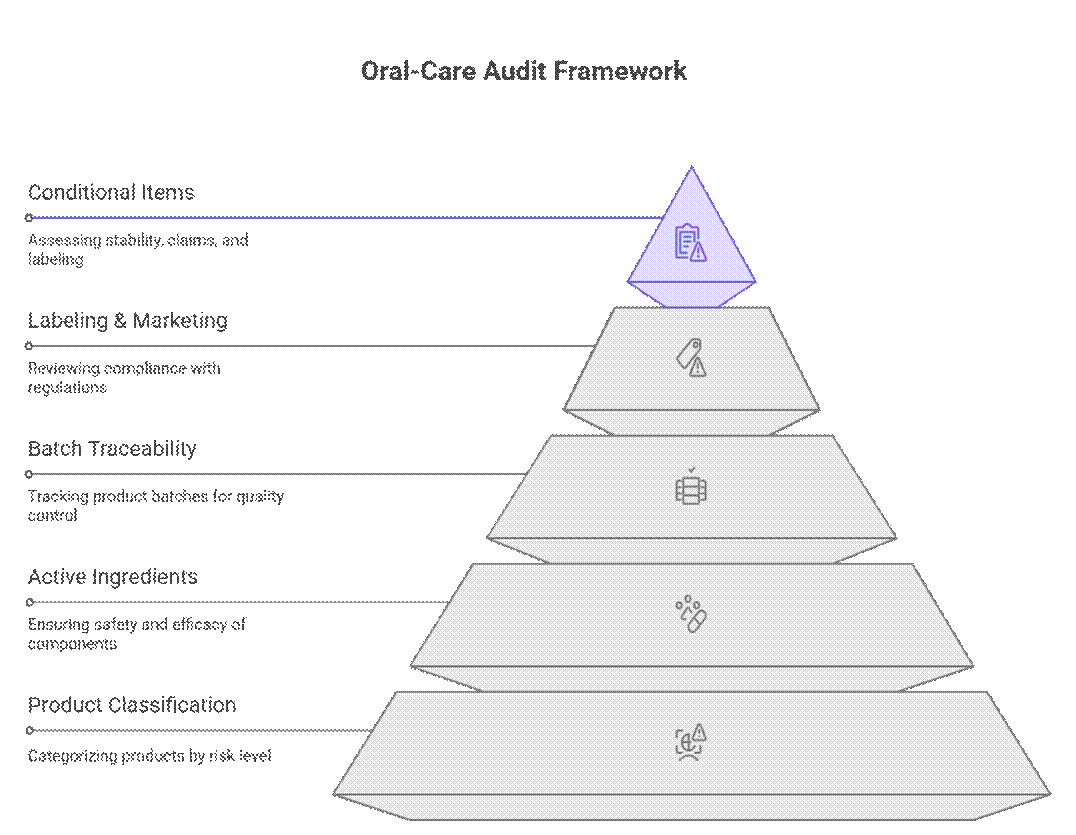
Gli enti regolatori affrontano gli audit e la conformità dei prodotti per l'igiene orale utilizzando un quadro di valutazione a più livelli basato sul rischio, che dà priorità alla classificazione del prodotto, ai principi attivi e alla tracciabilità dei lotti prima dell'etichettatura o della revisione per la commercializzazione. Solo dopo il superamento di questi controlli, esaminano elementi condizionali come la durata della stabilità, la fondatezza delle dichiarazioni o l'etichettatura transitoria.
Cosa controllano prima i revisori (non negoziabile)
I revisori iniziano con una serie rigorosa di requisiti che devono essere soddisfatti prima di poter procedere a qualsiasi ulteriore revisione.
- Classificazione del prodotto (cosmetico vs OTC / quasi farmaco)
La classificazione errata rimane uno degli errori più comuni nei requisiti di controllo dei dentifrici, in particolare quando i marchi non comprendono la classificazione dei prodotti per l'igiene orale tra cosmetici e OTC, legati ai principi attivi e alle affermazioni.
- Soglie dei principi attivi
Verifica il rispetto dei limiti per ingredienti quali fluoro o CPC, che possono comportare controlli sui farmaci da banco o a livello di farmaco.
- Registrazione del produttore e stato GMP
Garantisce che la struttura OEM sia correttamente registrata e operi secondo gli standard GMP approvati per produzione di prodotti per l'igiene orale.
- Tracciabilità dei lotti e prontezza al richiamo
Conferma l'esistenza di registri completi dei lotti per tracciare, isolare e richiamare rapidamente i prodotti se richiesto dalle autorità di regolamentazione o dai rivenditori.
Cosa è condizionatamente richiesto
Oltre ai requisiti non negoziabili, i revisori applicano una revisione basata sul rischio alla documentazione e ai test. L'applicazione delle normative varia in base al rischio di mercato e di prodotto, ma eventuali lacune spesso comportano ritardi o approvazioni condizionate.
- Durata della stabilità (accelerata vs. in tempo reale)
La stabilità accelerata può essere sufficiente per lanci anticipati o a basso rischio, ma la stabilità in tempo reale è spesso richiesta per prodotti con principi attivi, shelf life più lunghe o mercati più restrittivi come l'UE o il Consiglio di cooperazione del Golfo. Gli OEM più affermati implementano la stabilità in tempo reale in parallelo.
- Profondità della fondatezza della richiesta
Le dichiarazioni cosmetiche di base richiedono solitamente una giustificazione minima, mentre le dichiarazioni sulle prestazioni necessitano di dati di laboratorio o clinici. I revisori dei conti segnalano le dichiarazioni prive di prove o non corrispondenti alla formulazione finale.
- Lingua locale e formati di etichettatura
Le etichette in inglese possono essere valide per la revisione, ma l'approvazione finale richiede solitamente un'etichettatura conforme nella lingua locale. I revisori spesso segnalano sottoetichette mancanti, nomi di ingredienti errati o traduzioni di dichiarazioni rischiose.
Cosa è negoziabile (con un OEM forte)
Sebbene le normative appaiano rigide, i revisori esperti riconoscono le concrete realtà produttive. Con un OEM collaudato e una chiara roadmap di conformità, alcuni requisiti possono essere scaglionati o sequenziati senza bloccare l'ingresso sul mercato.

- Etichettatura transitoria
I revisori possono accettare l'etichettatura provvisoria per le prime tirature, se la grafica finale è approvata e programmata. Gli OEM più rinomati applicano la segregazione dei lotti e impediscono che le etichette non definitive vengano immesse sul mercato.
- Documentazione in fasi durante l'ampliamento
I revisori possono accettare l'etichettatura provvisoria per le prime tirature, se la grafica finale è approvata e programmata. Gli OEM più rinomati applicano la segregazione dei lotti e impediscono che le etichette non definitive vengano immesse sul mercato.
- Test paralleli durante le prove pilota
I produttori OEM più forti eseguono test di stabilità, microbiologici e di imballaggio durante i lotti pilota, riducendo di settimane o mesi i tempi di lancio.
Segnaposto visivo #1: Gerarchia dei requisiti di audit (prodotti per l'igiene orale)
| Livello di priorità di audit | Categoria di requisito | Cosa include | Impatto dell'audit se mancante |
| Livello 1 — Non negoziabile | Classificazione del prodotto | Determinazione di farmaci cosmetici vs OTC/quasi-farmaci, soglie di principio attivo | Fallimento immediato della verifica o fermo doganale |
| GMP e stato della struttura | ISO 22716, registrazione FDA, controlli igienici | Rifiuto della spedizione, squalifica della fabbrica | |
| Tracciabilità dei lotti | Registrazioni di lotti, prontezza al richiamo, codifica dei lotti | Azione correttiva obbligatoria, potenziale richiamo | |
| Livello 2 — Condizionalmente richiesto | Supporto alla stabilità | Stabilità accelerata e/o in tempo reale legata alla durata di conservazione | Approvazione condizionata, obbligo post-commercializzazione |
| Conferma della richiesta | Dati a supporto di affermazioni su sbiancamento, fluoro, placca e CPC | È richiesta la rimozione o la rietichettatura del reclamo | |
| Conformità all'etichettatura locale | Lingua, formato, convenzioni di denominazione degli ingredienti | Costi di rietichettatura, ritardo nel lancio | |
| Livello 3 — Negoziabile (dipendente dall'OEM) | Etichettatura transitoria | Illustrazione provvisoria con versioni finali approvate in archivio | Accettato con piano di tramonto documentato |
| Documentazione in fasi | Test a lungo termine differiti durante l'ampliamento | Accettato se valutato il rischio e programmato | |
| Test paralleli | Test di stabilità e microbiologici durante le prove pilota | Accettato con rigorosi controlli di lotto |
Da asporto OEM:
I marchi non superano gli audit perché trattano gli elementi di Livello 2 e Livello 3 come ipotesi facoltative anziché come rischi gestiti. Un OEM forte controlla questa gerarchia in modo proattivo.
Articoli di controllo specifici per l'igiene orale che i marchi non rilevano
La maggior parte dei fallimenti nei controlli di igiene orale non sono causati dalla mancanza di certificati. Si verificano quando i marchi applicano presupposti cosmetici generali a prodotti ad alto rischio con ingredienti attivi, dichiarazioni funzionali e uso quotidiano.

I revisori si concentrano su questi dettagli specifici per l'igiene orale fin da subito e le lacune spesso portano a ritardi, rietichettature o azioni correttive.
Elementi di controllo specifici per il dentifricio
Il dentifricio è sottoposto a controlli più severi a causa delle affermazioni di tipo attivo e terapeutico.
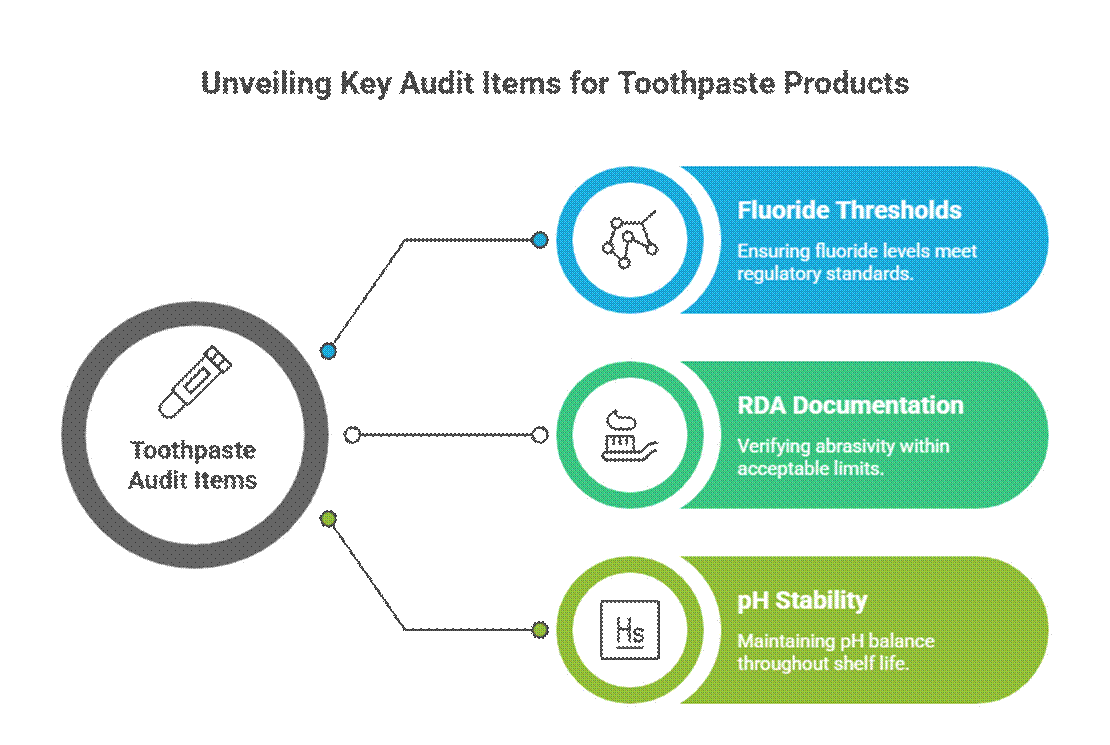
- Soglie di fluoro (rilevanza della monografia FDA)
Negli Stati Uniti, dentifricio al fluoro Devono essere conformi alla monografia FDA sul dentifricio al fluoro, inclusi concentrazione del principio attivo, formato dell'etichettatura e allineamento delle dichiarazioni. I revisori si aspettano inoltre la documentazione RDA per il dentifricio e i requisiti convalidati per i test di stabilità per l'igiene orale durante l'intera durata di conservazione.
- Documentazione RDA (limiti di abrasività)
Gli auditor si aspettano che i dati sull'abrasività relativa della dentina (RDA) confermino la sicurezza dello smalto. Valori RDA mancanti o eccessivi sono un segnale d'allarme comune, soprattutto per le formulazioni sbiancanti o al carbone.
- Stabilità del pH durante la conservazione
Il pH del dentifricio deve rimanere entro un intervallo sicuro e funzionale per tutta la sua durata di conservazione. I revisori esaminano i dati di stabilità per garantire che le variazioni di pH non compromettano l'efficacia del fluoro o la sicurezza orale.
Elementi di controllo specifici per il collutorio
Verifiche di conformità del collutorio concentrarsi molto sul controllo microbico e sulla concentrazione attiva, in particolare per le formule che richiedono la documentazione di conformità al CPC per il collutorio e i test di efficacia dei conservanti.
- Classificazioni tra bevande analcoliche e bevande contenenti alcol
Il dentifricio è sottoposto a controlli più severi a causa delle affermazioni di tipo attivo e terapeutico.
- Documentazione CPC %
I revisori verificano i limiti di concentrazione e dichiarano l'allineamento per le formule contenenti CPC.
- Rapporti sui test di sfida microbica
I test di verifica mancanti o obsoleti spesso comportano approvazioni condizionate.
- Test di efficacia dei conservanti
I sistemi di conservazione deboli vengono considerati rischi per la sicurezza del prodotto.
Segnali di pericolo dei prodotti sbiancanti
Gli auditor esaminano attentamente le affermazioni normative sui dentifrici sbiancanti, in particolare il linguaggio che implica modifiche dello smalto, sbiancamento permanente o risultati terapeutici che possono innescare una supervisione a livello di farmaco.

- Dichiarazioni sullo sbiancamento vs. dichiarazioni sui farmaci (Stati Uniti)
Le affermazioni che implicano alterazioni dello smalto o risultati terapeutici possono comportare la classificazione del farmaco.
- Divulgazione perossido/non perossido
I revisori dei conti richiedono una chiara informativa sui principi attivi sbiancanti e sulle concentrazioni.
- Formulazione della richiesta che innesca la revisione normativa
I revisori dei conti richiedono una chiara informativa sui principi attivi sbiancanti e sulle concentrazioni.
Da asporto OEM:
Le verifiche sull'igiene orale falliscono per quanto riguarda principi attivi e dichiarazioni, non per quanto riguarda l'estetica del packaging.
CTA #1 a metà articolo: Scarica il pacchetto di conformità di esempio
Esaminare la documentazione OEM anonima e pronta per la verifica prima di impegnarsi in un quantitativo minimo d'ordine o di finalizzare un lancio sul mercato.
Quadri di controllo regionali (focalizzati sull'esecuzione)
Gli audit variano a seconda della regione, ma la logica è la stessa: gli enti regolatori valutano prima il rischio del prodotto, poi la documentazione e infine l'etichettatura. Ciò che cambia è il luogo in cui avviene l'applicazione delle norme.
Stati Uniti — FDA e MoCRA
L'applicazione della legge negli Stati Uniti si concentra sempre più sui requisiti di audit della FDA per l'igiene orale, con Conformità all'igiene orale MoCRA ampliare la responsabilità post-commercializzazione per i marchi di prodotti per l'igiene orale.
- Albero decisionale cosmetico vs. OTC
La classificazione errata è un fattore scatenante comune per l'applicazione della legge.
- Registrazione della struttura e elenco dei prodotti
I revisori verificano l'accuratezza della registrazione MoCRA e l'allineamento SKU.
- Registri batch e preparazione agli eventi avversi
I marchi devono dimostrare di disporre di sistemi di tracciabilità e di gestione dei reclami.
- Promesse di sbiancamento: dove i marchi oltrepassano il limite
Le affermazioni esagerate sulle proprietà sbiancanti spesso innescano controlli rigorosi sui farmaci.
Unione Europea — CPNP e PIF
La conformità UE in materia di igiene orale tramite CPNP e PIF richiede il pieno allineamento tra formulazione, etichettatura e requisiti CPSR per i prodotti per l'igiene orale, con responsabilità a carico della persona responsabile.

- Ruolo di persona responsabile (RP)
L'RP deve controllare e accedere al file informativo completo del prodotto.
- Aspettative di valutazione della sicurezza
I CPSR generici vengono spesso rifiutati per i prodotti per l'igiene orale.
- Controlli di stabilità, CPSR ed etichettatura
Le incongruenze tra i documenti sono punti di errore comuni.
- Esposizione alla responsabilità dell'importatore
La responsabilità ricade sul produttore o sull'importatore, non sull'OEM.
Medio Oriente — GSO 1943
Registrazione per l'igiene orale GSO 1943 esercita una pressione sui controlli doganali, rendendo l'accuratezza dell'etichettatura e la coerenza delle dichiarazioni essenziali per lo sdoganamento delle spedizioni.
- Tempistiche di registrazione del prodotto
Le richieste incomplete spesso comportano il ripristino del processo.
- Requisiti di etichettatura in arabo
Le sottoetichette in arabo mancanti o errate causano spesso il blocco delle spedizioni.
- Cause comuni di sequestro doganale
Modifiche alle etichette successive all'invio e incongruenze nella documentazione.
Micro-caso: blocco doganale UE causato dalla deriva della documentazione
Un distributore europeo ha importato un dentifricio sbiancante al fluoro prodotto da un OEM di fascia bassa. Sebbene la formulazione fosse conforme, la spedizione è stata bloccata alla dogana a causa di incongruenze tra il File Informativo del Prodotto (PIF), i dati di stabilità e le dichiarazioni finali sull'etichetta. Il CPSR faceva riferimento a una versione precedente della formulazione; la stabilità in tempo reale non era stata avviata e le dichiarazioni di sbiancamento superavano quanto approvato dal valutatore della sicurezza.
Il risultato è stato un fermo doganale di quattro settimane, una rietichettatura obbligatoria e 11.800 euro di costi imprevisti, mentre il capitale di inventario è rimasto inutilizzato. Se le versioni delle formulazioni, i protocolli di stabilità e la documentazione comprovante le richieste fossero stati bloccati prima della presentazione, la spedizione sarebbe stata sdoganata senza alcun intervento.
Ecco perché i produttori OEM esperti nel settore dell'igiene orale eseguono test di stabilità paralleli, congelano le versioni delle formulazioni prima della finalizzazione del PIF ed eseguono revisioni dei rischi di reclamo prima dell'approvazione della grafica, prevenendo così deviazioni nella documentazione che i revisori segnalano immediatamente.
Chiarimento sulla responsabilità
La solida conformità alle GMP OEM per l'igiene orale, supportata dalla norma di produzione per l'igiene orale ISO 22716, garantisce che gli auditor possano verificare i requisiti di tracciabilità dei lotti per l'igiene orale senza azioni correttive o richiami.
In Oralabx supportiamo i marchi separando chiaramente la responsabilità legale dal supporto all'esecuzione, fornendo documentazione specifica per lotto e pronta per la verifica, segnalando al contempo i rischi di classificazione e reclamo prima che diventino problemi di applicazione.
Responsabilità dell'importatore rispetto all'OEM (sezione Chiarezza)
Una chiara separazione delle responsabilità è essenziale per superare gli audit sull'igiene orale ed evitare responsabilità post-commercializzazione. Le autorità di regolamentazione non valutano l'"intento" o gli accordi informali, ma valutano chi è legalmente responsabile e chi controlla i documenti. Quando i ruoli non sono chiari, l'applicazione delle norme spetta di default all'importatore, anche se l'OEM ha eseguito la maggior parte delle attività di conformità.
Di cosa è legalmente responsabile l'importatore
Indipendentemente dal supporto dell'OEM, le autorità di regolamentazione attribuiscono la responsabilità finale alla parte che immette il prodotto sul mercato. Gli importatori non possono esternalizzare questi obblighi senza un'esplicita riassegnazione legale.

- Autorizzazione all'immissione in commercio
Garantire l'approvazione legale prima della vendita.
- Approvazione dei reclami
Tutte le dichiarazioni di marketing e sulle confezioni rientrano nella responsabilità dell'importatore.
- Conservazione della documentazione al dettaglio
Gli importatori devono conservare e presentare i documenti di conformità su richiesta, tra cui l'accesso PIF, i CoA, le SDS e i registri di tracciabilità dei lotti.
Cosa deve fornire un OEM competente
Un OEM qualificato per l'igiene orale supporta l'esecuzione della conformità fornendo documentazione verificabile e pronta per la verifica, collegata direttamente a ciascun lotto di produzione.
- Certificazione GMP
Attuale, certificazione GMP riconosciuta a livello regionale (ad esempio, ISO 22716) che dimostra sistemi di produzione, igiene e qualità controllati.
- Registri dei lotti e tracciabilità
Registri completi di produzione in lotti, codifica dei lotti e tracciabilità dei richiami che collegano materie prime, cicli di produzione e prodotti finiti.
- CoA, SDS, stabilità e rapporti microbici
Certificati di analisi specifici per lotto, schede di sicurezza, studi di stabilità e report di test microbici/di sfida allineati alla formulazione finale.
- Documentazione di esportazione
Fatture commerciali, liste di imballaggio, dichiarazioni e documenti di supporto all'esportazione accurati e coerenti con i dati e l'etichettatura dei prodotti registrati.
Segnaposto visivo #2: Tabella delle responsabilità tra importatore e OEM
Questa tabella chiarisce come gli enti regolatori assegnano le responsabilità durante gli audit sull'igiene orale e dove termina il supporto OEM e inizia la responsabilità legale.
Responsabilità dell'importatore rispetto all'OEM (conformità all'igiene orale)
| Area di conformità | Importatore (responsabilità legale) | OEM (supporto all'esecuzione) |
| Classificazione del prodotto | Decisione finale sulla classificazione | Input di formulazione e flag di rischio |
| Autorizzazione all'immissione in commercio | Registrazione, notifica, nomina RP | Preparazione dei dati e dei documenti |
| Approvazione dei reclami | Rivendicazione di legalità e fondatezza | Revisione dei rischi di reclamo e supporto dei dati |
| Conformità GMP | Verifica la qualificazione OEM | Mantiene i sistemi e gli audit GMP |
| Tracciabilità dei lotti | Conserva e produce registrazioni | Crea record di lotto e codifica dei lotti |
| Dati di stabilità e sicurezza | Garantisce l'adeguatezza per il mercato | Esegue test e rilascia report |
| Conformità dell'etichettatura | Approvazione finale dell'etichetta | Revisione delle opere d'arte e guida al formato |
| Preparazione all'audit al dettaglio | Conservazione dei documenti | Fornitura e aggiornamento dei documenti |
| Applicazione e richiami | Responsabilità finanziaria e legale | Supporto tecnico alle indagini |
Chiarimento fondamentale:
Gli OEM garantiscono la conformità, ma gli importatori si assumono il rischio normativo, a meno che la responsabilità non venga riassegnata contrattualmente. Questa distinzione è fondamentale per i risultati degli audit e l'esposizione post-commercializzazione.
Cosa fa realmente un BUON OEM durante un audit
A RUIQIGO, Gli audit non sono trattati come eventi documentali. I nostri team OEM progettano sistemi di produzione tenendo conto dei requisiti normativi fin dal primo giorno, integrando la tracciabilità dei lotti, il controllo attivo e la verifica della conformità direttamente nella produzione giornaliera.
Flusso di lavoro di conformità OEM (esecuzione reale)
Durante un audit, gli OEM competenti dimostrano la conformità attraverso il controllo dei processi, non tramite documenti cartacei reattivi. Gli auditor valutano se i sistemi sono integrati nelle operazioni di produzione quotidiane.
- Validazione della formulazione al banco
Le formulazioni vengono convalidate su scala industriale per confermare le concentrazioni attive, l'intervallo di pH e la compatibilità degli ingredienti prima dell'aumento di scala.
- Stabilità accelerata + in tempo reale
La stabilità accelerata supporta le presentazioni tempestive, mentre gli studi in tempo reale vengono eseguiti in parallelo per convalidare la durata di conservazione e rilevare la deriva della formulazione.
- Creazione di fogli batch
Ogni ciclo di produzione è supportato da schede di lotto che documentano materie prime, parametri di processo, controlli in corso d'opera e codici di lotto.
- Test microbici e chimici
I prodotti finiti vengono sottoposti a test microbiologici e verifiche chimiche per confermarne la sicurezza, l'efficacia dei conservanti e la conformità dei principi attivi.
- Emissione CoA
I certificati di analisi specifici per lotto vengono emessi e sottoposti a verifica incrociata rispetto alle specifiche prima del rilascio.
- Documentazione doganale e di esportazione
I documenti di spedizione, le dichiarazioni e i file di conformità vengono allineati con i dati dei prodotti registrati per evitare discrepanze doganali.
Come falliscono i produttori di basso livello
Gli insuccessi degli audit sono spesso dovuti a debolezze sistemiche piuttosto che a errori isolati. Produttori di fascia bassa in genere non dispongono di infrastrutture di conformità e rispondono solo quando emergono problemi.
- Manca la tracciabilità del lotto
Registri di lotti inadeguati o incoerenti impediscono richiami efficaci e minano immediatamente la fiducia del revisore.
- Riutilizzo generico delle SDS
I file SDS riciclati o non specifici per lotto indicano uno scarso controllo della formulazione e vengono spesso segnalati durante gli audit.
- Nessuna revisione del rischio di reclamo
I produttori che non valutano il rischio normativo legato alle affermazioni di marketing espongono i marchi a classificazioni errate e ad azioni coercitive.
- Conformità reattiva (non proattiva)
La conformità viene trattata come una richiesta di documenti dell'ultimo minuto anziché come un sistema di produzione integrato, il che comporta ritardi, azioni correttive e audit non riusciti.
Scatola da asporto OEM:
Le carenze di conformità sono errori di produzione, non problemi burocratici. I revisori penalizzano i sistemi deboli, non i file mancanti.
CTA #2 di metà articolo: Richiesta di chiamata di consulenza RP/MoCRA
Chiarire la responsabilità dell'importatore, i rischi di classificazione del prodotto e le lacune nella documentazione con uno specialista della conformità prima della presentazione o della spedizione normativa.
Cronologia di audit visualizzata (facoltativa ma efficace)
Le tempistiche di audit variano a seconda della regione, ma i ritardi si verificano sempre negli stessi punti di esecuzione: decisioni di classificazione, documentazione incompleta e correzioni di etichettatura in fase avanzata. Capire dove si perde effettivamente tempo consente ai marchi di pianificare i lanci in modo realistico ed evitare blocchi di inventario.

Segnaposto visivo #3: grafico della cronologia degli audit (USA vs UE vs Medio Oriente)
Confronto delle tempistiche di controllo dell'igiene orale
| Fase di revisione | Stati Uniti (FDA / MoCRA) | Unione Europea (CPNP / PIF) | Medio Oriente (GSO 1943) |
| Classificazione del prodotto | Decisione cosmetica vs. da banco | Classificazione cosmetica | Classificazione cosmetica |
| Qualifica di stabilimento/OEM | Registrazione della struttura | Qualificazione OEM tramite RP | Revisione dei dati OEM |
| Revisione della sicurezza e della stabilità | Pre-mercato limitato | CPSR + revisione della stabilità | Revisione della stabilità |
| Revisione delle affermazioni e delle etichette | Moderare | Rigoroso, pre-mercato | Rigoroso, pre-mercato |
| Registrazione/notifica | Elenco dei prodotti | Notifica CPNP | Registrazione del prodotto |
| Sdoganamento | Applicazione post-commercializzazione | Minimo al confine | Elevata applicazione |
| Ingresso nel mercato | Ingresso anticipato consentito | Inserimento dopo l'approvazione | Inserimento dopo l'approvazione |
| Applicazione post-commercializzazione | Alto | Moderare | Basso-moderato |
Da asporto OEM:
Il time-to-market è compresso da flussi di lavoro di conformità paralleli, non saltando passaggi.
Conclusione (chiusura commerciale)
Il successo a lungo termine nell'igiene orale dipende da sistemi strutturati, non da burocrazia reattiva. I marchi che considerano gli audit e la conformità dei prodotti per l'igiene orale come una disciplina di produzione, non come un compito di presentazione, proteggono margini, tempistiche e fiducia dei rivenditori. Per i marchi che ampliano le SKU di dentifrici, collutori o sbiancanti, Oralabx opera come partner per l'esecuzione della conformità, allineando i sistemi di formulazione, documentazione e lotti alle realtà di audit negli Stati Uniti, nell'UE e in Medio Oriente, in modo che l'approvazione normativa si trasformi in un accesso al mercato prevedibile.
Domande frequenti
D1. Chi è legalmente responsabile se un controllo di igiene orale non riesce: l'importatore o l'OEM?
L'importatore è legalmente responsabile per impostazione predefinita. Gli OEM possono supportare l'esecuzione della conformità, ma la responsabilità viene trasferita solo se esplicitamente riassegnata per contratto e accettata dalle autorità di regolamentazione.
D2. Gli SKU dei collutori in bustina singola richiedono una documentazione completa sulla conformità?
Sì. I formati delle bustine non sono esenti. Gli auditor valutano la formulazione, le dichiarazioni e i dati di sicurezza indipendentemente dalle dimensioni della confezione.
D3. I campioni di collutorio in bustina singola possono essere spediti senza SDS o Certificato di analisi?
Nella maggior parte dei casi, no. I campioni possono essere trasportati in determinate eccezioni, ma la SDS e il Certificato di identificazione (CoA) sono comunemente richiesti alla dogana, soprattutto per i prodotti liquidi per l'igiene orale.
D4. Quanto tempo prima del lancio dovrebbero iniziare i lavori di conformità?
Idealmente, 3-6 mesi prima del lancio. Per i prodotti con principi attivi o proprietà sbiancanti, è opportuno iniziare a pianificare la conformità ancora prima.
D5. Le inserzioni su Amazon richiedono un certificato di affidabilità (CoA) o una scheda di sicurezza (SDS)?
Amazon richiede spesso CoA, SDS e documenti di conformità durante l'approvazione dell'inserimento nell'elenco o gli audit successivi all'inserimento nell'elenco, in particolare per i prodotti per l'igiene orale.
D6. Quali documenti devono essere conservati a livello di rivenditore?
In genere, i rivenditori richiedono l'accesso a CoA, SDS, registri di tracciabilità dei lotti e prova di autorizzazione all'immissione in commercio su richiesta.
D7. Negli Stati Uniti, le affermazioni sui prodotti sbiancanti sono considerate affermazioni sui farmaci?
Possono. Le affermazioni che implicano uno sbiancamento permanente, un'alterazione dello smalto o effetti terapeutici spesso innescano controlli a livello di farmaco.
D8. Una persona responsabile dell'UE può gestire anche i mercati del Consiglio di cooperazione del Golfo?
No. I mercati del Consiglio di cooperazione del Golfo richiedono procedure di registrazione e conformità locali separate; una dichiarazione di conformità UE non copre automaticamente gli obblighi normativi del Medio Oriente.
CTA finale: Lista di controllo della conformità in formato PDF
Evita ritardi di controllo, costi di rietichettatura e fermi doganali.
Scarica il nostro PDF sulla checklist per la conformità all'igiene orale o parla direttamente con un Specialista della conformità OEM per convalidare la documentazione prima del lancio.