Introduksjon
Denne veiledningen er skrevet for innkjøpsledere, merkevaregründere og compliance-ansvarlige som skaffer tannkrem, munnskyll og hviteprodukter, og som er ansvarlige for å få munnpleieprodukter godkjent og plassert i hyllene. Revisjoner og samsvar med regelverk for munnpleieprodukter er de viktigste årsakene til lanseringsforsinkelser, tollstopp, ommerkingskostnader og mislykket onboarding i detaljhandelen – ikke formuleringskvalitet.

Munnpleie ansikter strengere gransking enn generell kosmetikk på grunn av aktive ingredienser, påstander og sporbarhet av batcher, og en fire ukers tollforsinkelse kan inneholde et sekssifret beløp i kontanter med minimumsbeløp (MOQ). Denne artikkelen går gjennom revisjonslogikk region for region, munnhygienespesifikke krav og tydelige OEM- kontra importøransvar.
På Oralabx, vi jobber spesifikt med merkevarer på dette feilpunktet – der formuleringen kan være klar, men samsvarsgjennomføring avgjør om en SKU faktisk når markedet.
Hvordan munnhygienekontroller faktisk fungerer (obligatorisk vs. valgfritt)
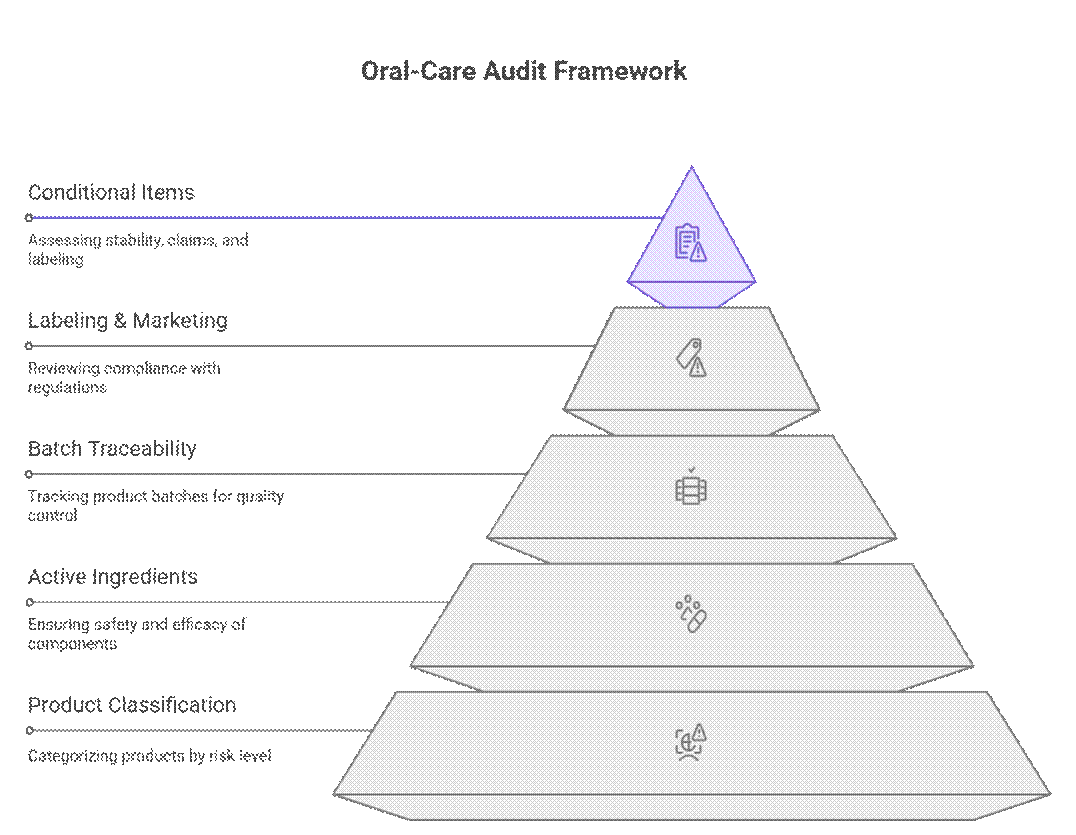
Regulatorer håndterer revisjoner og samsvar av munnpleieprodukter ved hjelp av et nivåbasert, risikobasert rammeverk som prioriterer produktklassifisering, aktive ingredienser og sporbarhet av batcher før merking eller markedsføringsgjennomgang. Først etter at disse er bestått, gjennomgår de betingede punkter som stabilitetsvarighet, dokumentasjon av påstander eller overgangsmerking.
Hva revisorer sjekker først (ikke-forhandlingsbart)
Revisorer starter med et strengt sett med krav som må oppfylles før videre gjennomgang kan fortsette.
- Produktklassifisering (kosmetikk vs. reseptfrie / kvasi-legemidler)
Feilklassifisering er fortsatt en av de vanligste feilene i revisjonskravene for tannkrem, spesielt når merkevarer misforstår terskler for klassifisering av munnpleieprodukter, kosmetikk kontra reseptfrie produkter, knyttet til aktive ingredienser og påstander.
- Terskler for aktive ingredienser
Verifiserer samsvar med grenseverdier for ingredienser som fluor eller CPC, noe som kan utløse tilsyn på reseptfrie eller legemiddelnivå.
- Produsentregistrering og GMP-status
Sørger for at OEM-anlegget er riktig registrert og opererer under godkjente GMP-standarder for produksjon av munnpleie.
- Sporbarhet og tilbakekallingsberedskap for batcher
Bekrefter at det finnes komplette batchregistre for å spore, isolere og raskt tilbakekalle produkter hvis det kreves av regulatorer eller forhandlere.
Hva er betinget påkrevd
Utover det som ikke er mulig å forhandle om, gjennomfører revisorer en risikobasert gjennomgang av dokumentasjon og testing. Håndheving varierer avhengig av markeds- og produktrisiko, men hull fører ofte til forsinkelser eller betingede godkjenninger.
- Stabilitetsvarighet (akselerert vs. sanntid)
Akselerert stabilitet kan være nok for tidlige lanseringer eller lanseringer med lav risiko, men sanntidsstabilitet er ofte nødvendig for produkter med aktive ingredienser, lengre holdbarhet eller strengere markeder som EU eller GCC. Sterke OEM-er kjører sanntidsstabilitet parallelt.
- Krav om dokumentasjonsdybde
Grunnleggende kosmetiske påstander krever vanligvis minimal begrunnelse, mens ytelsespåstander trenger laboratorie- eller kliniske data. Revisorer flagger påstander som mangler bevis eller ikke samsvarer med den endelige formuleringen.
- Lokalt språk og merkingsformater
Engelske etiketter kan fungere for gjennomgang, men endelig godkjenning krever vanligvis samsvarende merking på lokalt språk. Revisorer flagger ofte manglende underetiketter, feil ingrediensnavn eller risikable oversettelser av påstander.
Hva er omsettelig (med en sterk OEM)
Selv om regelverket virker strengt, erkjenner erfarne revisorer praktiske produksjonsrealiteter. Med en dokumentert OEM og en tydelig samsvarsplan kan noen krav fases eller sekvenseres uten å blokkere markedsadgang.

- Overgangsmerking
Revisorer kan godta midlertidig merking for tidlige serier hvis det endelige kunstverket er godkjent og planlagt. Sterke OEM-produsenter håndhever batch-separasjon og forhindrer at ikke-endelige etiketter kommer inn i detaljhandelen.
- Etappevis dokumentasjon under oppskalering
Revisorer kan godta midlertidig merking for tidlige serier hvis det endelige kunstverket er godkjent og planlagt. Sterke OEM-produsenter håndhever batch-separasjon og forhindrer at ikke-endelige etiketter kommer inn i detaljhandelen.
- Parallell testing under pilotkjøringer
Sterke OEM-er kjører stabilitets-, mikrobielle og emballasjetester under pilotbatcher, noe som reduserer lanseringstidslinjene med uker eller måneder.
Visuell plassholder #1: Hierarki for revisjonskrav (munnpleieprodukter)
| Prioritetsnivå for revisjon | Kravkategori | Hva dette inkluderer | Revisjonspåvirkning hvis manglende |
| Nivå 1 – Ikke-forhandlingsbart | Produktklassifisering | Bestemmelse av kosmetisk kontra reseptfrie/kvasimedisiner, terskler for aktive ingredienser | Umiddelbar revisjonsfeil eller tollhold |
| GMP og status for anlegget | ISO 22716, FDA-registrering, hygienekontroller | Forsendelsesavvisning, fabrikkdiskvalifikasjon | |
| Sporbarhet av batcher | Batchregistreringer, tilbakekallingsklargjøring, lotkoding | Obligatorisk korrigerende tiltak, potensiell tilbakekalling | |
| Nivå 2 – Betinget påkrevd | Stabilitetsstøtte | Akselerert og/eller sanntidsstabilitet knyttet til holdbarhet | Betinget godkjenning, forpliktelse etter markedsføring |
| Begrunnelse av påstand | Data som støtter påstander om hvitning, fluor, plakk og CPC | Fjerning eller ommerking av krav kreves | |
| Samsvar med lokale merkingsregler | Språk, format, navngivningskonvensjoner for ingredienser | Kostnader for ommerking, lanseringsforsinkelse | |
| Nivå 3 – Kan forhandles (OEM-avhengig) | Overgangsmerking | Midlertidig kunstverk med godkjente endelige versjoner arkivert | Godkjent med dokumentert solnedgangsplan |
| Iscenesatt dokumentasjon | Utsatte langsiktige tester under oppskalering | Godkjent hvis risikovurdert og planlagt | |
| Parallell testing | Stabilitets- og mikrobielle tester under pilotforsøk | Godkjent med sterke batchkontroller |
OEM-takeaway:
Merkevarer stryker på revisjoner ved å behandle nivå 2- og nivå 3-elementer som valgfri gjetting i stedet for styrt risiko. En sterk OEM kontrollerer dette hierarkiet proaktivt.
Spesifikke revisjonspunkter for munnhygiene Merker savner
De fleste feil i revisjoner av munnhygiene skyldes ikke manglende sertifikater. De oppstår når merkevarer anvender generelle kosmetiske antagelser på produkter med høyere risiko med aktive ingredienser, funksjonelle påstander og daglig bruk.

Revisorer fokuserer på disse munnhygienespesifikke detaljene tidlig, og mangler fører ofte til forsinkelser, ommerking eller korrigerende tiltak.
Tannkremspesifikke revisjonspunkter
Tannkrem blir revidert mer aggressivt på grunn av påstander om aktiv og terapeutisk bruk.
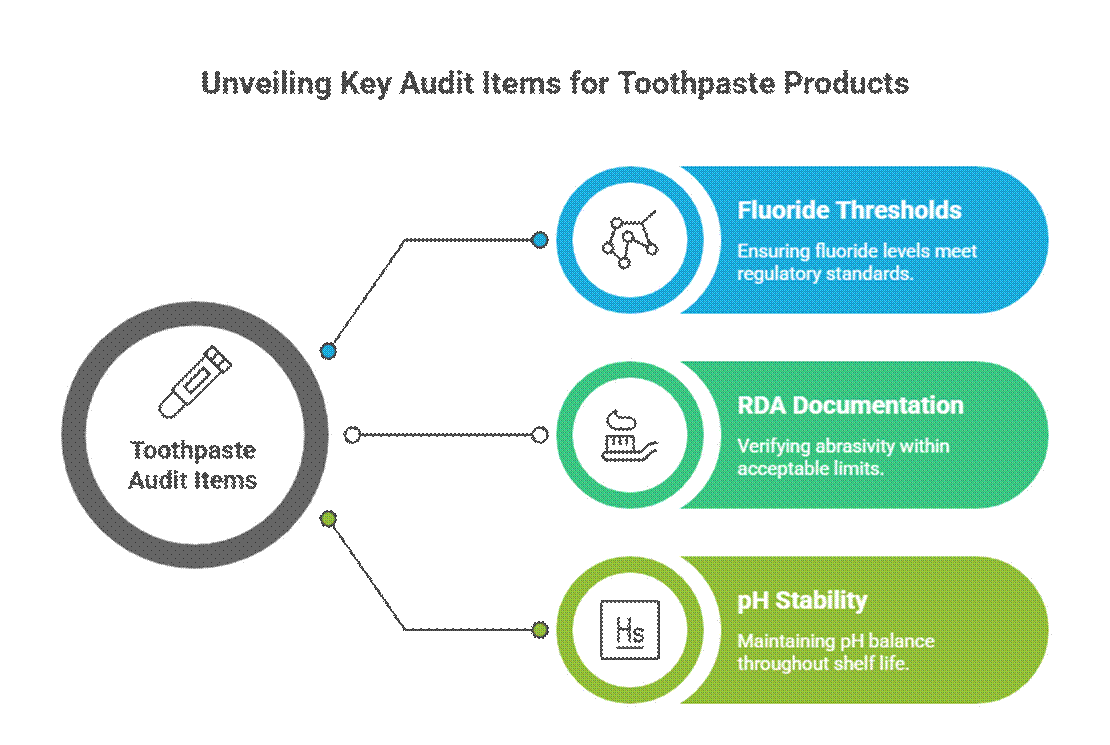
- Fluorgrenser (relevans for FDA-monografi)
I USA, fluortannkrem må overholde FDA-monografien for fluortannkrem, inkludert aktiv konsentrasjon, merkingsformat og samsvar med krav. Revisorer forventer også RDA-dokumentasjon for tannkrem og validerte krav til testing av munnhygienestabilitet over hele holdbarheten.
- RDA-dokumentasjon (slitasjegrenser)
Revisorer forventer at data om relativ dentinsliphet (RDA) bekrefter emaljens sikkerhet. Manglende eller for høye RDA-verdier er et vanlig rødt flagg, spesielt for bleking eller kullformuleringer.
- pH-stabilitet over holdbarheten
Tannkremens pH-verdi må holde seg innenfor et trygt, funksjonelt område gjennom hele holdbarheten. Revisorer gjennomgår stabilitetsdata for å sikre at pH-forskyvning ikke går utover fluoridens effektivitet eller orale sikkerhet.
Munnvannspesifikke revisjonspunkter
Samsvarskontroller for munnvann fokuser sterkt på mikrobiell kontroll og aktiv konsentrasjon, spesielt for formler som krever dokumentasjon på samsvar med CPC-munnskyllevann og testing av konserveringsmiddeleffektivitet.
- Klassifiseringer av alkoholfrie kontra alkoholholdige
Tannkrem blir revidert mer aggressivt på grunn av påstander om aktiv og terapeutisk bruk.
- CPC %-dokumentasjon
Revisorer kontrollerer konsentrasjonsgrenser og samsvarer med krav for CPC-holdige formler.
- Rapporter om mikrobiell utfordringstest
Manglende eller utdaterte utfordringstester fører ofte til betingede godkjenninger.
- Testing av konserveringsmiddeleffektivitet
Svake konserveringssystemer behandles som produktsikkerhetsrisikoer.
Røde flagg for hviteprodukter
Revisorer gransker nøye påstander om regulatoriske krav til hvitende tannkrem, spesielt språkbruk som antyder emaljemodifisering, permanent hviting eller terapeutiske resultater som kan utløse tilsyn på legemiddelnivå.

- Påstander om hvitning kontra påstander om legemidler (USA)
Påstander som antyder endring av emalje eller terapeutiske resultater kan utløse legemiddelklassifisering.
- Opplysning om peroksid/ikke-peroksid
Revisorer krever tydelig offentliggjøring av hviteaktive stoffer og konsentrasjoner.
- Kravformulering som utløser myndighetsgjennomgang
Revisorer krever tydelig offentliggjøring av hviteaktive stoffer og konsentrasjoner.
OEM-takeaway:
Revisjoner av munnpleie mislykkes på virkestoffer og påstander, ikke på emballasjens estetikk.
Oppfordring til handling midt i artikkelen #1: Last ned eksempelpakke for samsvar
Gjennomgå anonymisert, revisjonsklar OEM-dokumentasjon før du bestemmer MOQ eller fullfører en markedslansering.
Regionale revisjonsrammeverk (utførelsesfokusert)
Revisjoner varierer fra region til region, men logikken er konsistent: Regulatorer vurderer produktrisiko først, dokumentasjon deretter og merking sist. Det som er forskjellig er hvor håndheving skjer.
USA — FDA og MoCRA
Amerikansk håndheving fokuserer i økende grad på FDAs krav til revisjon av munnhygiene, med MoCRA-samsvar med munnhygiene utvidet ansvarlighet etter markedet for merker innen munnpleie.
- Kosmetisk vs. reseptfri beslutningstre
Feilklassifisering er en vanlig utløser for håndheving.
- Registrering av anlegg og produktliste
Revisorer verifiserer nøyaktigheten av MoCRA-registreringen og SKU-samsvar.
- Batchregistreringer og beredskap for bivirkninger
Merker må demonstrere sporbarhets- og klagehåndteringssystemer.
- Hvitningspåstander: der merkevarer går over grensen
Overdrevne påstander om hvitning utløser ofte legemiddelgranskning.
Den europeiske union — CPNP og PIF
Samsvar med EUs regler for munnpleie via CPNP og PIF krever full samsvar mellom formulering, merking og CPSR-krav for munnpleieprodukter, med ansvaret hos den ansvarlige personen.

- Rollen til ansvarlig person (RP)
RP-en må kontrollere og ha tilgang til hele produktinformasjonsfilen.
- Forventninger til sikkerhetsvurdering
Generiske CPSR-er blir ofte avvist for munnpleieprodukter.
- Stabilitets-, CPSR- og merkekontroller
Inkonsekvenser på tvers av dokumenter er vanlige feilpunkter.
- Importøransvarsekponering
Ansvaret ligger hos RP eller importør, ikke OEM-en.
Midtøsten — GSO 1943
GSO 1943 registrering for munnpleie legger håndhevingspress på tollvesenet, noe som gjør nøyaktighet i merking og konsistens i innsendinger avgjørende for klarering av forsendelser.
- Tidslinjer for produktregistrering
Ufullstendige innsendinger tilbakestiller ofte prosessen.
- Krav til arabisk merking
Manglende eller feilaktige arabiske underetiketter forårsaker ofte forsendelsesforsinkelser.
- Vanlige årsaker til tollbeslag
Endringer i etiketter etter innsending og avvik i dokumentasjon.
Mikrosak: EU-tollhold forårsaket av dokumentasjonsavvik
En europeisk distributør importerte en fluorblekingstannkrem produsert av en lavnivå-OEM. Selv om selve formuleringen var i samsvar med kravene, ble forsendelsen stoppet i tollen på grunn av uoverensstemmelser mellom produktinformasjonsfilen (PIF), stabilitetsdata og endelige etikettpåstander. CPSR refererte til en tidligere formuleringsversjon; stabilitet i sanntid var ikke igangsatt, og blekingspåstandene oversteg det sikkerhetsvurdereren hadde godkjent.
Resultatet ble fire ukers tollstopp, obligatorisk ommerking og 11 800 euro i uplanlagte kostnader – mens lagerkapitalen sto ubrukt. Hadde formuleringsversjoner, stabilitetsprotokoller og dokumentasjon av påstander vært låst før innsending, ville forsendelsen ha blitt klarert uten inngripen.
Dette er grunnen til at erfarne OEM-er innen munnpleie kjører parallell stabilitetstesting, fryser formuleringsversjoner før PIF-ferdigstillelse og utfører risikovurderinger av krav før godkjenning av kunstverk – noe som forhindrer dokumentasjonsavvik som revisorer umiddelbart flagger.
Ansvarsavklaring
Sterk GMP-samsvar med OEM-standardene for munnpleie, støttet av ISO 22716-produksjon av munnpleieprodukter, sikrer at revisorer kan verifisere sporbarhetskrav for munnpleiepartier uten korrigerende tiltak eller tilbakekallinger.
Hos Oralabx støtter vi merkevarer ved å tydelig skille juridisk ansvar fra utførelsesstøtte – vi leverer batchspesifikk, revisjonsklar dokumentasjon samtidig som vi flagger klassifiserings- og kravrisikoer før de blir håndhevingsproblemer.
Importør vs. OEM-ansvar (avklaringsdelen)
Tydelig ansvarsdeling er avgjørende for å bestå revisjoner av munnpleieprodukter og unngå ansvar etter markedsføring. Regulatorer vurderer ikke “intensjon” eller uformelle forståelser – de vurderer hvem som er juridisk ansvarlig og hvem som kontrollerer dokumentene. Når rollene er uklare, faller håndhevingen på importøren, selv om OEM-en utførte de fleste samsvarsoppgavene.
Hva importøren er juridisk ansvarlig for
Uavhengig av OEM-støtte, tildeler regulatorer det endelige ansvaret til den parten som bringer produktet på markedet. Importører kan ikke outsource disse forpliktelsene uten eksplisitt juridisk omplassering.

- Markedsgodkjenning
Sikre juridisk godkjenning før salg.
- Godkjenning av krav
All markedsføring og påstander på emballasjen faller inn under importørens ansvar.
- Oppbevaring av dokumentasjon i detaljhandelen
Importører må oppbevare og fremlegge samsvarsdokumenter på forespørsel, inkludert PIF-tilgang, COA-er, SDS og sporbarhetsregistre for batcher.
Hva en kompetent OEM må tilby
En kvalifisert OEM-produsent for munnpleie støtter samsvarsgjennomføring ved å levere verifiserbar, revisjonsklar dokumentasjon knyttet direkte til hvert produksjonsparti.
- GMP-sertifisering
Nåværende, regionsgodkjent GMP-sertifisering (f.eks. ISO 22716) som demonstrerer kontrollerte produksjons-, hygiene- og kvalitetssystemer.
- Batchregistreringer og sporbarhet
Fullfør produksjonslogger for batch, lotkoding og sporbarhet for tilbakekalling som knytter sammen råvarer, produksjonsserier og ferdige varer.
- CoA, SDS, stabilitets- og mikrobielle rapporter
Batchspesifikke analysesertifikater, sikkerhetsdatablader, stabilitetsstudier og mikrobielle/eksponeringstestrapporter i samsvar med den endelige formuleringen.
- Eksporter dokumentasjon
Nøyaktige handelsfakturaer, pakklister, deklarasjoner og støttende eksportdokumenter i samsvar med registrerte produktdata og merking.
Visuell plassholder #2: Tabell for importør- vs. OEM-ansvar
Denne tabellen tydeliggjør hvordan regulatorer fordeler ansvar under revisjoner av munnpleie, og hvor OEM-støtten slutter og det juridiske ansvaret begynner.
Importør vs. OEM-ansvar (samsvar med munnhygiene)
| Samsvarsområde | Importør (juridisk ansvar) | OEM (Utførelsesstøtte) |
| Produktklassifisering | Endelig klassifiseringsbeslutning | Formuleringsinndata og risikoflagg |
| Markedsgodkjenning | Registrering, varsling, RP-avtale | Data- og dokumentforberedelse |
| Godkjenning av krav | Påstand om lovlighet og dokumentasjon | Gjennomgang av kravrisiko og datastøtte |
| GMP-samsvar | Verifiserer OEM-kvalifikasjon | Vedlikeholder GMP-systemer og revisjoner |
| Sporbarhet av batcher | Oppbevarer og produserer registre | Oppretter batchoppføringer og lotkoding |
| Stabilitets- og sikkerhetsdata | Sikrer tilstrekkelighet for markedet | Utfører tester og problemrapporter |
| Samsvar med merking | Endelig godkjenning av etiketten | Veiledning om gjennomgang av kunstverk og formatering |
| Beredskap for revisjon av detaljhandel | Dokumentoppbevaring | Dokumentlevering og oppdateringer |
| Håndheving og tilbakekallinger | Finansielt og juridisk ansvar | Teknisk etterforskningsstøtte |
Viktig avklaring:
OEM-produsenter muliggjør samsvar, men importører bærer regulatorisk risiko med mindre ansvaret er kontraktsmessig omfordelt. Dette skillet er sentralt for revisjonsresultater og eksponering etter markedsføring.
Hva en GOD OEM faktisk gjør under en revisjon
På RUIQIGO, revisjoner behandles ikke som dokumenthendelser. Våre OEM-team designer produksjonssystemer rundt regulatoriske kontrollpunkter fra dag én – og integrerer batchsporbarhet, aktiv kontroll og samsvarsverifisering direkte i den daglige produksjonen.
OEM-samsvarsarbeidsflyt (ekte utførelse)
Under en revisjon demonstrerer kompetente OEM-produsenter samsvar gjennom prosesskontroll, ikke reaktivt papirarbeid. Revisorer vurderer om systemer er innebygd i den daglige produksjonsdriften.
- Validering av benkformulering
Formuleringer valideres i benkskala for å bekrefte aktive konsentrasjoner, pH-område og ingredienskompatibilitet før oppskalering.
- Akselerert + stabilitet i sanntid
Akselerert stabilitet støtter tidlige innsendinger, mens sanntidsstudier kjøres parallelt for å validere holdbarhet og oppdage formuleringsavvik.
- Oppretting av batchark
Hver produksjonskjøring støttes av batchark som dokumenterer råvarer, prosessparametere, kontroller i prosessen og lotkoder.
- Mikrobiell og kjemisk testing
Ferdige varer gjennomgår mikrobiell testing og kjemisk verifisering for å bekrefte sikkerhet, konserveringsmiddelegenskaper og samsvar med aktive ingredienser.
- Utstedelse av CoA
Batchspesifikke analysesertifikater utstedes og kryssjekkes mot spesifikasjoner før utgivelse.
- Eksport- og tolldokumentasjon
Fraktdokumenter, deklarasjoner og samsvarsfiler er samkjørt med registrerte produktdata for å forhindre tollavvik.
Hvordan lavnivåprodusenter mislykkes
Revisjonsfeil kan ofte spores tilbake til systemiske svakheter snarere enn isolerte feil. Lavnivåprodusenter mangler vanligvis infrastruktur for samsvar og reagerer bare når problemer dukker opp.
- Manglende sporbarhet for batcher
Mangelfulle eller inkonsistente batchregistreringer hindrer effektive tilbakekallinger og undergraver umiddelbart revisors tillit.
- Generisk gjenbruk av sikkerhetsdatablad
Resirkulerte eller ikke-batchspesifikke sikkerhetsdatabladfiler signaliserer dårlig formuleringskontroll og blir ofte flagget under revisjoner.
- Ingen vurdering av kravrisiko
Produsenter som ikke vurderer regulatorisk risiko knyttet til markedsføringspåstander, utsetter merkevarer for feilklassifisering og håndhevingstiltak.
- Reaktiv (ikke proaktiv) samsvar
Samsvar behandles som en dokumentforespørsel i siste liten snarere enn et integrert produksjonssystem, noe som fører til forsinkelser, korrigerende tiltak og mislykkede revisjoner.
OEM takeaway-boks:
Manglende samsvar er produksjonsfeil, ikke papirarbeidsproblemer. Revisorer straffer svake systemer, ikke manglende filer.
Midt i artikkelen CTA #2: Be om RP / MoCRA-konsultasjonssamtale
Avklar importøransvar, risikoer knyttet til produktklassifisering og dokumentasjonshull med en samsvarsspesialist før innsending eller forsendelse av regelverk.
Visualisert revisjonstidslinje (valgfritt, men tydelig)
Revisjonsfrister varierer fra region til region, men forsinkelser oppstår konsekvent på de samme utførelsespunktene – klassifiseringsbeslutninger, ufullstendig dokumentasjon og merkingskorrigeringer i sen fase. Å forstå hvor tid faktisk går tapt, lar merkevarer planlegge lanseringer realistisk og unngå lagerstopp.

Visuell plassholder #3: Tidslinjediagram for revisjon (USA vs. EU vs. Midtøsten)
Sammenligning av tidslinje for revisjon av munnhygiene
| Revisjonsfasen | USA (FDA / MoCRA) | Den europeiske union (CPNP / PIF) | Midtøsten (GSO 1943) |
| Produktklassifisering | Kosmetikk vs. reseptfri avgjørelse | Kosmetisk klassifisering | Kosmetisk klassifisering |
| Anlegg / OEM-kvalifisering | Registrering av anlegg | OEM-kvalifisering via RP | OEM-datagjennomgang |
| Gjennomgang av sikkerhet og stabilitet | Begrenset førmarked | CPSR + stabilitetsgjennomgang | Stabilitetsgjennomgang |
| Gjennomgang av påstander og merking | Moderat | Streng, førmarkedsføring | Streng, førmarkedsføring |
| Registrering/melding | Produktliste | CPNP-varsel | Produktregistrering |
| Toll og klarering | Håndheving etter markedsføring | Minimalt ved grensen | Høy håndheving |
| Markedsføring | Tidlig innreise tillatt | Inngang etter godkjenning | Inngang etter godkjenning |
| Håndheving etter markedsføring | Høy | Moderat | Lav-moderat |
OEM-takeaway:
Tid til markedet komprimeres av parallelle samsvarsarbeidsflyter, ikke ved å hoppe over trinn.
Konklusjon (kommersiell avslutning)
Langsiktig suksess innen munnhygiene avhenger av strukturerte systemer, ikke reaktivt papirarbeid. Merker som behandler revisjoner og samsvar med munnhygieneprodukter som en produksjonsdisiplin, ikke en innsendingsoppgave, beskytter marginer, tidslinjer og forhandlernes tillit. For merker som skalerer tannkrem-, munnskyll- eller hvitningsprodukt-SKU-er, fungerer Oralabx som en samsvarspartner – og tilpasser formulering, dokumentasjon og batchsystemer til revisjonsrealiteter i USA, EU og Midtøsten, slik at regulatorisk godkjenning omdannes til forutsigbar markedsadgang.
Vanlige spørsmål
Q1. Hvem er juridisk ansvarlig hvis en revisjon av munnhygiene mislykkes – importør eller OEM?
Importøren er juridisk ansvarlig per standard. OEM-produsenter kan støtte samsvarsgjennomføring, men ansvaret endres bare hvis det eksplisitt er omfordelt gjennom kontrakt og akseptert av regulatorer.
Q2. Krever SKU-er for munnvann i enkeltposer full samsvarsdokumentasjon?
Ja. Poseformater er ikke unntatt. Revisorer vurderer formulering, påstander og sikkerhetsdata uavhengig av pakningsstørrelse.
Q3. Kan munnvannsprøver i én pose sendes uten sikkerhetsdatablad eller COA?
I de fleste tilfeller, nei. Prøver kan transporteres under begrensede unntak, men sikkerhetsdatablad og COA er ofte påkrevd i tollen, spesielt for flytende munnpleieprodukter.
Q4. Hvor lenge før lansering bør samsvarsarbeidet starte?
Ideelt sett 3–6 måneder før lansering. Produkter med aktive ingredienser eller påstander om hvitning bør starte planleggingen for samsvar enda tidligere.
Q5. Krever Amazon-oppføringer CoA eller SDS?
Amazon ber ofte om COA-er, SDS-er og samsvarsdokumenter under godkjenning av notering eller revisjoner etter notering, spesielt for munnpleieprodukter.
Q6. Hvilke dokumenter må oppbevares på forhandlernivå?
Forhandlere krever vanligvis tilgang til COAer, SDS, sporbarhetsregistreringer for batcher og bevis på markedsføringstillatelse på forespørsel.
Q7. Teller påstander om hvitning som påstander om legemidler i USA?
Det kan de. Påstander som antyder permanent bleking, endring av emalje eller terapeutiske effekter utløser ofte gransking på legemiddelnivå.
Q8. Kan en ansvarlig person i EU også håndtere GCC-markeder?
Nei. GCC-markeder krever separate lokale registrerings- og samsvarsprosesser; en EU RP dekker ikke automatisk regulatoriske forpliktelser i Midtøsten.
Endelig handlingsfremmende tiltak: Samsvarssjekkliste PDF
Unngå revisjonsforsinkelser, kostnader for ommerking og tollforsinkelser.
Last ned vår sjekkliste for samsvar med munnhygiene i PDF-format, eller snakk direkte med en OEM-samsvarsspesialist for å validere dokumentasjonen din før lansering.







