Introducción
Esta guía está dirigida a líderes de compras, fundadores de marcas y gerentes de cumplimiento normativo que se encargan de la adquisición de pastas dentales, enjuagues bucales y productos blanqueadores, responsables de la aprobación y comercialización de los SKU de cuidado bucal. Las auditorías y el cumplimiento normativo de los productos de cuidado bucal son las principales causas de retrasos en el lanzamiento, retenciones en aduanas, costos de reetiquetado y fallos en la integración en el mercado minorista, no la calidad de la formulación.

Caras de cuidado bucal Un escrutinio más estricto que el de los cosméticos generales debido a los ingredientes activos, las reclamaciones y la trazabilidad de los lotes, y una retención aduanera de 4 semanas puede retener cantidades de pedido mínimas de seis cifras. Este artículo desglosa la lógica de auditoría por región, los requisitos específicos para el cuidado bucal y las claras responsabilidades entre fabricantes de equipos originales (OEM) e importadores.
En Oralabx, Trabajamos con marcas específicamente en este punto de falla, donde la formulación puede estar lista, pero la ejecución del cumplimiento determina si un SKU realmente llega al mercado.
Cómo funcionan realmente las auditorías de cuidado bucal (obligatorias vs. opcionales)
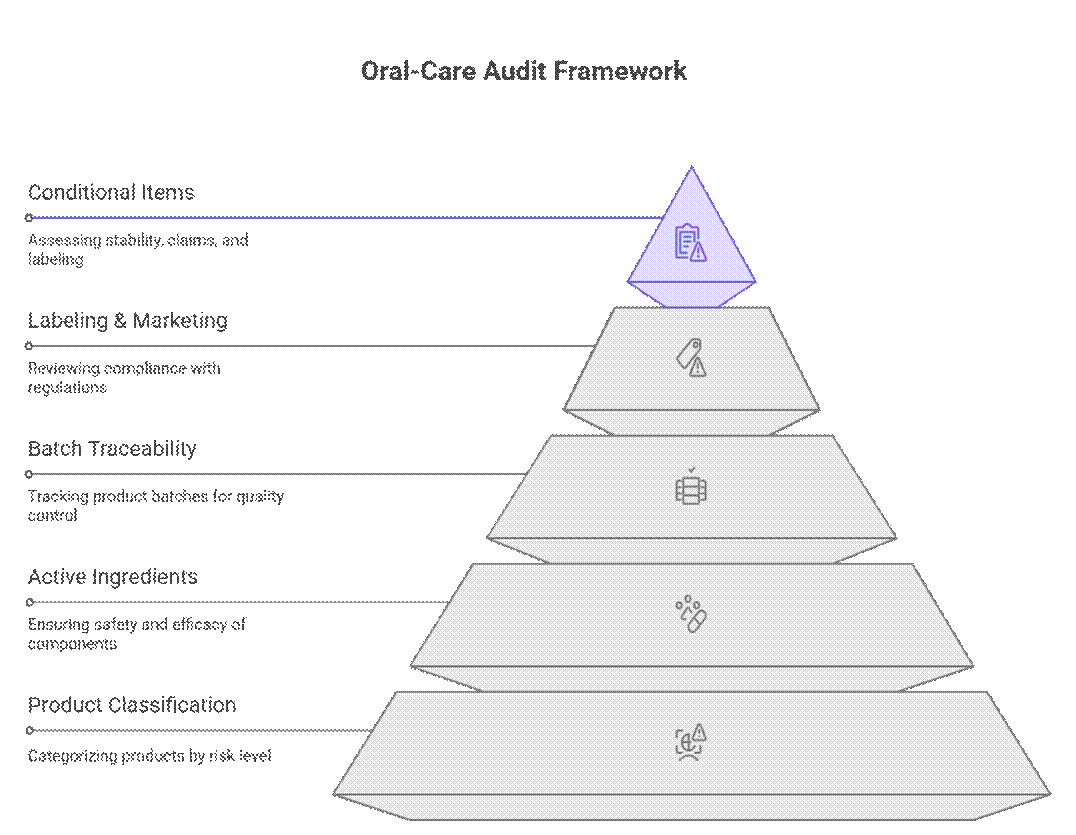
Los organismos reguladores abordan las auditorías y el cumplimiento normativo de los productos de cuidado bucal mediante un marco escalonado basado en el riesgo que prioriza la clasificación del producto, los ingredientes activos y la trazabilidad del lote antes de su etiquetado o revisión de comercialización. Solo después de aprobar estos requisitos, revisan elementos condicionales como la duración de la estabilidad, la justificación de las afirmaciones o el etiquetado transitorio.
Lo que los auditores verifican primero (no negociable)
Los auditores comienzan con un conjunto estricto de requisitos que deben cumplirse antes de que pueda procederse a cualquier revisión adicional.
- Clasificación de productos (cosméticos vs. OTC/cuasi-fármaco)
La clasificación errónea sigue siendo uno de los fallos más comunes en los requisitos de auditoría de pasta de dientes, en particular cuando las marcas malinterpretan los umbrales de clasificación de productos para el cuidado bucal (cosméticos vs. OTC) vinculados a los principios activos y las afirmaciones.
- Umbrales de ingredientes activos
Verifica el cumplimiento de los límites para ingredientes como el flúor o el CPC, que pueden desencadenar una supervisión a nivel de medicamento o de venta libre.
- Registro del fabricante y estado GMP
Garantiza que las instalaciones OEM estén debidamente registradas y operen bajo los estándares GMP aprobados para producción de cuidado bucal.
- Trazabilidad de lotes y preparación para retiradas
Confirma que existen registros de lotes completos para rastrear, aislar y retirar productos rápidamente si lo requieren los reguladores o los minoristas.
¿Qué se requiere condicionalmente?
Más allá de los aspectos no negociables, los auditores aplican una revisión basada en riesgos a la documentación y las pruebas. La aplicación varía según el mercado y el riesgo del producto, pero las deficiencias a menudo provocan retrasos o aprobaciones condicionales.
- Duración de la estabilidad (acelerada vs. en tiempo real)
La estabilidad acelerada puede ser suficiente para lanzamientos tempranos o de bajo riesgo, pero la estabilidad en tiempo real suele ser necesaria para productos con principios activos, vidas útiles más largas o mercados más estrictos como la UE o el CCG. Los fabricantes de equipos originales (OEM) más sólidos gestionan la estabilidad en tiempo real en paralelo.
- Profundidad de la fundamentación de la reclamación
Las afirmaciones cosméticas básicas suelen requerir una justificación mínima, mientras que las de rendimiento requieren datos clínicos o de laboratorio. Los auditores detectan las afirmaciones que carecen de evidencia o no se ajustan a la formulación final.
- Idioma local y formatos de etiquetado
Las etiquetas en inglés pueden ser útiles para la revisión, pero la aprobación final suele requerir un etiquetado en el idioma local que cumpla con las normas. Los auditores suelen detectar subetiquetas faltantes, nombres de ingredientes incorrectos o traducciones de declaraciones arriesgadas.
¿Qué es negociable (con un OEM fuerte)?
Aunque las regulaciones parecen rígidas, los auditores experimentados reconocen las realidades prácticas de la fabricación. Con un OEM de eficacia demostrada y una hoja de ruta de cumplimiento clara, algunos requisitos pueden implementarse por etapas o secuenciarse sin obstaculizar la entrada al mercado.

- Etiquetado transicional
Los auditores pueden aceptar el etiquetado provisional para las primeras tiradas si el diseño final está aprobado y programado. Los fabricantes de equipos originales (OEM) rigurosos aplican la segregación de lotes e impiden que las etiquetas no finales entren en el comercio minorista.
- Documentación por etapas durante la ampliación
Los auditores pueden aceptar el etiquetado provisional para las primeras tiradas si el diseño final está aprobado y programado. Los fabricantes de equipos originales (OEM) rigurosos aplican la segregación de lotes e impiden que las etiquetas no finales entren en el comercio minorista.
- Pruebas paralelas durante las ejecuciones piloto
Los fabricantes de equipos originales (OEM) más fuertes realizan pruebas de estabilidad, microbiológicas y de envasado durante lotes piloto, lo que acorta los plazos de lanzamiento en semanas o meses.
Marcador visual #1: Jerarquía de requisitos de auditoría (productos de cuidado bucal)
| Nivel de prioridad de auditoría | Categoría de requisito | Qué incluye esto | Impacto de la auditoría si falta |
| Nivel 1 — No negociable | Clasificación de productos | Determinación de cosméticos frente a medicamentos de venta libre o cuasifármacos, umbrales de ingredientes activos | Fallo inmediato de auditoría o retención aduanera |
| Estado de las BPM y de las instalaciones | ISO 22716, registro FDA, controles de higiene | Rechazo de envío, descalificación de fábrica | |
| Trazabilidad de lotes | Registros de lotes, preparación para retiradas, codificación de lotes | Acción correctiva obligatoria, posible retirada del mercado | |
| Nivel 2 — Requerido condicionalmente | Soporte de estabilidad | Estabilidad acelerada y/o en tiempo real ligada a la vida útil | Aprobación condicional, obligación post-comercialización |
| Justificación de la reclamación | Datos que respaldan las afirmaciones sobre blanqueamiento, flúor, placa y CPC | Se requiere la eliminación o el reetiquetado de una reclamación | |
| Cumplimiento del etiquetado local | Convenciones de nomenclatura de idioma, formato e ingredientes | Costos de reetiquetado, retraso en el lanzamiento | |
| Nivel 3 — Negociable (Dependiente del OEM) | Etiquetado transicional | Obra de arte provisional con versiones finales aprobadas en archivo | Aceptado con plan de puesta al día documentado |
| Documentación por etapas | Pruebas a largo plazo diferidas durante la ampliación | Aceptado si se evalúa el riesgo y se programa | |
| Pruebas paralelas | Pruebas de estabilidad y microbianas durante pruebas piloto | Aceptado con fuertes controles de lotes |
Conclusión del OEM:
Las marcas no superan las auditorías al tratar los elementos de Nivel 2 y Nivel 3 como conjeturas opcionales en lugar de un riesgo gestionado. Un OEM sólido controla esta jerarquía de forma proactiva.
Elementos de auditoría específicos del cuidado bucal que las marcas pasan por alto
La mayoría de las fallas en las auditorías de cuidado bucal no se deben a la falta de certificados. Se producen cuando las marcas aplican supuestos cosméticos generales a productos de alto riesgo con ingredientes activos, afirmaciones funcionales y uso diario.

Los auditores se centran en estos detalles específicos del cuidado bucal desde el principio, y las lagunas a menudo provocan demoras, reetiquetado o acciones correctivas.
Elementos de auditoría específicos de la pasta de dientes
La pasta de dientes se audita de forma más agresiva debido a sus afirmaciones de estilo activo y terapéutico.
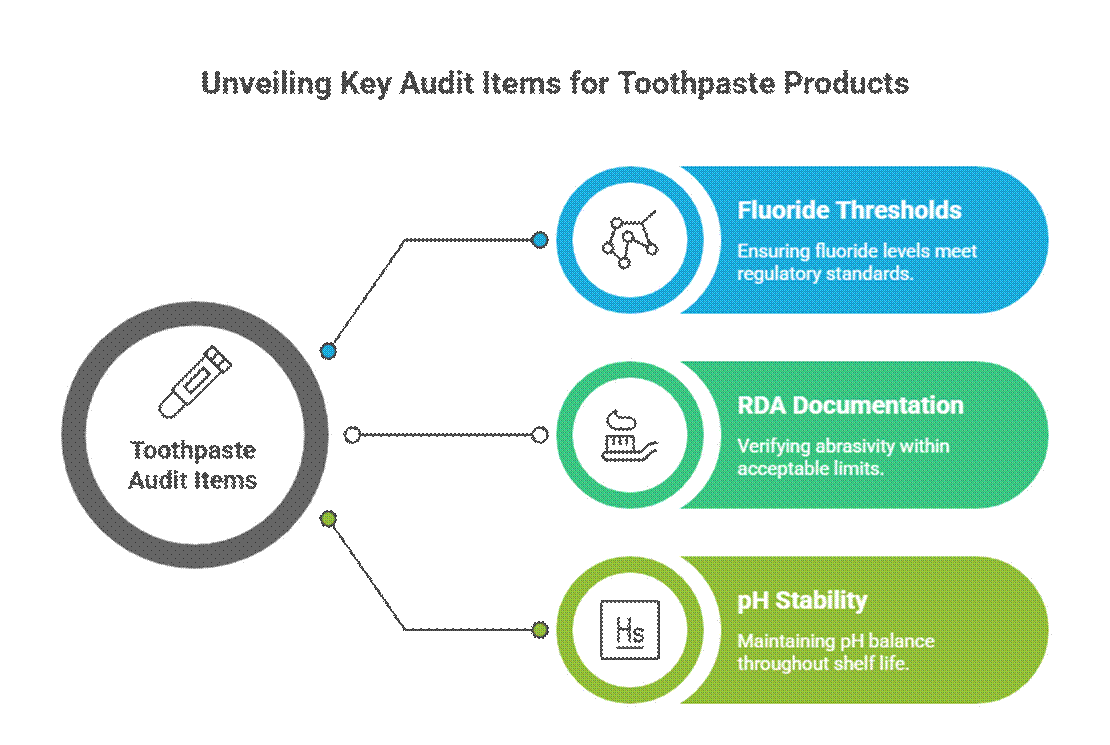
- Umbrales de fluoruro (relevancia para la monografía de la FDA)
En los Estados Unidos, pasta de dientes con flúor Debe cumplir con la monografía de la FDA sobre pastas dentales con flúor, incluyendo la concentración activa, el formato de etiquetado y la alineación de las afirmaciones. Los auditores también esperan la documentación de la RDA para la pasta dental y los requisitos validados de pruebas de estabilidad para el cuidado bucal durante toda su vida útil.
- Documentación RDA (límites de abrasividad)
Los auditores esperan que los datos de abrasividad dentinaria relativa (RDA) confirmen la seguridad del esmalte. La ausencia o el exceso de valores de RDA son una señal de alerta común, especialmente en formulaciones de blanqueamiento o carbón.
- Estabilidad del pH durante la vida útil
El pH de la pasta dental debe mantenerse dentro de un rango seguro y funcional durante toda su vida útil. Los auditores revisan los datos de estabilidad para garantizar que la variación del pH no comprometa la eficacia del flúor ni la seguridad bucal.
Elementos de auditoría específicos del enjuague bucal
Auditorías de cumplimiento de enjuagues bucales se centran principalmente en el control microbiano y la concentración activa, especialmente para fórmulas que requieren documentación de cumplimiento del enjuague bucal CPC y pruebas de eficacia de conservantes.
- Clasificaciones de sin alcohol vs. con alcohol
La pasta de dientes se audita de forma más agresiva debido a sus afirmaciones de estilo activo y terapéutico.
- Documentación del CPC %
Los auditores verifican los límites de concentración y la alineación de las reclamaciones para las fórmulas que contienen CPC.
- Informes de pruebas de provocación microbiana
Las pruebas de desafío faltantes u obsoletas a menudo conducen a aprobaciones condicionales.
- Pruebas de eficacia de los conservantes
Los sistemas de conservación débiles se consideran riesgos para la seguridad del producto.
Señales de alerta de los productos blanqueadores
Los auditores examinan en detalle las afirmaciones regulatorias sobre las pastas dentales blanqueadoras, en particular el lenguaje que implica modificación del esmalte, blanqueamiento permanente o resultados terapéuticos que pueden desencadenar una supervisión a nivel del medicamento.

- Afirmaciones de blanqueamiento vs. afirmaciones sobre medicamentos (EE. UU.)
Las afirmaciones que implican alteraciones del esmalte o resultados terapéuticos pueden desencadenar la clasificación de un fármaco.
- Divulgación de peróxido/no peróxido
Los auditores exigen una divulgación clara de los ingredientes activos blanqueadores y sus concentraciones.
- Redacción de una reclamación que desencadena una revisión regulatoria
Los auditores exigen una divulgación clara de los ingredientes activos blanqueadores y sus concentraciones.
Conclusión del OEM:
Las auditorías de cuidado bucal fallan en los ingredientes activos y las afirmaciones, no en la estética del empaque.
CTA de mitad de artículo #1: Descargar paquete de cumplimiento de muestra
Revise la documentación OEM anónima y lista para auditoría antes de comprometer el MOQ o finalizar un lanzamiento al mercado.
Marcos de auditoría regionales (centrados en la ejecución)
Las auditorías varían según la región, pero la lógica es la misma: los reguladores evalúan primero el riesgo del producto, después la documentación y por último el etiquetado. La diferencia radica en dónde se aplica la normativa.
Estados Unidos — FDA y MoCRA
La aplicación de la normativa estadounidense se centra cada vez más en los requisitos de auditoría de la FDA sobre el cuidado bucal, con Cumplimiento de la normativa de cuidado bucal de MoCRA Ampliar la responsabilidad posterior a la comercialización de las marcas de cuidado bucal.
- Árbol de decisiones sobre productos cosméticos y de venta libre
La clasificación errónea es un desencadenante común de la aplicación de la ley.
- Registro de instalaciones y listado de productos
Los auditores verifican la precisión del registro de MoCRA y la alineación de SKU.
- Registros de lotes y preparación para eventos adversos
Las marcas deben demostrar sistemas de trazabilidad y manejo de quejas.
- Afirmaciones de blanqueamiento: dónde las marcas cruzan la línea
Las afirmaciones exageradas sobre los beneficios del blanqueamiento a menudo desencadenan el escrutinio de los medicamentos.
Unión Europea — CPNP y PIF
El cumplimiento de las normas de cuidado bucal de la UE a través del CPNP y el PIF exige una alineación completa entre la formulación, el etiquetado y los requisitos del CPSR para los productos de cuidado bucal, y la responsabilidad recae en la persona responsable.

- Rol de Persona Responsable (PR)
El RP debe controlar y acceder al Archivo de Información del Producto completo.
- Expectativas de evaluación de seguridad
Los CPSR genéricos se rechazan con frecuencia para productos de cuidado bucal.
- Controles de estabilidad, CPSR y etiquetado
Las inconsistencias entre documentos son puntos de falla comunes.
- Exposición a la responsabilidad del importador
La responsabilidad recae en el RP o importador, no en el OEM.
Oriente Medio — GSO 1943
Registro de cuidado bucal GSO 1943 coloca presión en la aduana, haciendo que la precisión del etiquetado y la consistencia en la presentación sean fundamentales para el despacho del envío.
- Plazos de registro de productos
Los envíos incompletos a menudo reinician el proceso.
- Requisitos de etiquetado en árabe
Las subetiquetas árabes faltantes o incorrectas suelen provocar retenciones de envíos.
- Causas comunes de embargo aduanero
Cambios de etiquetas posteriores al envío y discrepancias en la documentación.
Microcaso: Retención en la aduana de la UE causada por la falta de documentación
Un distribuidor europeo importó una pasta dental blanqueadora con flúor producida por un fabricante de equipos originales (OEM) de bajo nivel. Si bien la fórmula cumplía con las normas, el envío fue detenido en la aduana debido a inconsistencias entre el Expediente de Información del Producto (PIF), los datos de estabilidad y las afirmaciones de la etiqueta final. El CPSR hizo referencia a una versión anterior de la fórmula; no se había iniciado la evaluación de la estabilidad en tiempo real, y las afirmaciones de blanqueamiento excedían lo aprobado por el asesor de seguridad.
El resultado fue una retención aduanera de cuatro semanas, un reetiquetado obligatorio y 11.800 € en costes imprevistos, mientras el capital de inventario permanecía inactivo. Si las versiones de la formulación, los protocolos de estabilidad y la justificación de las reclamaciones se hubieran bloqueado antes del envío, el envío se habría despachado sin intervención.
Es por esto que los fabricantes de equipos originales (OEM) con experiencia en cuidado bucal realizan pruebas de estabilidad en paralelo, congelan versiones de fórmulas antes de la finalización del PIF y realizan revisiones de riesgo de reclamos antes de la aprobación del diseño, lo que previene desviaciones de la documentación que los auditores detectan de inmediato.
Aclaración de responsabilidad
El sólido cumplimiento de las Buenas Prácticas de Manufactura (GMP) de los fabricantes de equipos originales (OEM) para el cuidado bucal, respaldado por la norma ISO 22716 de fabricación de productos para el cuidado bucal, garantiza que los auditores puedan verificar los requisitos de trazabilidad de los lotes de productos para el cuidado bucal sin acciones correctivas ni retiradas del mercado.
En Oralabx, apoyamos a las marcas separando claramente la responsabilidad legal del apoyo en la ejecución, brindando documentación específica para cada lote y lista para auditoría, al tiempo que señalamos los riesgos de clasificación y reclamo antes de que se conviertan en problemas de cumplimiento.
Responsabilidad del importador vs. del OEM (Sección de Claridad)
Una clara separación de responsabilidades es esencial para aprobar las auditorías de higiene bucal y evitar responsabilidades posteriores a la comercialización. Los reguladores no evalúan la intención ni los acuerdos informales, sino quién es legalmente responsable y quién controla los documentos. Cuando las funciones no están claras, la responsabilidad de cumplimiento recae en el importador, incluso si el fabricante de equipos originales (OEM) realizó la mayoría de las tareas de cumplimiento.
De qué es legalmente responsable el importador
Independientemente del apoyo del OEM, los reguladores asignan la responsabilidad final a quien comercializa el producto. Los importadores no pueden externalizar estas obligaciones sin una reasignación legal explícita.

- Autorización de comercialización
Garantizar la aprobación legal antes de la venta.
- Aprobación de reclamaciones
Todas las afirmaciones de marketing y en el envase son responsabilidad del importador.
- Retención de documentación minorista
Los importadores deben conservar y presentar los documentos de cumplimiento cuando se les solicite, incluido el acceso a PIF, CoA, SDS y registros de trazabilidad de lotes.
Lo que un OEM competente debe proporcionar
Un OEM de cuidado bucal calificado respalda la ejecución del cumplimiento al proporcionar documentación verificable y lista para auditoría, vinculada directamente a cada lote de producción.
- Certificación GMP
Actual, Certificación GMP reconocida por la región (por ejemplo, ISO 22716) que demuestra sistemas de fabricación, higiene y calidad controlados.
- Registros de lotes y trazabilidad
Registros completos de fabricación por lotes, codificación de lotes y trazabilidad de retiros que vinculan materias primas, series de producción y productos terminados.
- Informes de CoA, SDS, estabilidad y microbios
Certificados de análisis específicos de cada lote, hojas de datos de seguridad, estudios de estabilidad e informes de pruebas microbianas/de desafío alineados con la formulación final.
- Documentación de exportación
Facturas comerciales, listas de embalaje, declaraciones y documentos de respaldo de exportación precisos y consistentes con los datos y el etiquetado del producto registrado.
Marcador visual #2: Tabla de responsabilidades del importador frente al OEM
Esta tabla aclara cómo los reguladores asignan la responsabilidad durante las auditorías de cuidado bucal y dónde termina el apoyo del OEM y comienza la responsabilidad legal.
Responsabilidad del importador frente al OEM (cumplimiento de las normas de cuidado bucal)
| Área de Cumplimiento | Importador (Responsabilidad legal) | OEM (Soporte de ejecución) |
| Clasificación de productos | Decisión de clasificación final | Entrada de formulación y banderas de riesgo |
| Autorización de comercialización | Registro, notificación, cita de RP | Preparación de datos y documentos |
| Aprobación de reclamaciones | Reclamación de legalidad y fundamentación | Revisión de riesgos de reclamaciones y soporte de datos |
| Cumplimiento de las BPM | Verifica la calificación del OEM | Mantiene sistemas GMP y auditorías |
| Trazabilidad de lotes | Conserva y produce registros | Crea registros de lotes y codificación de lotes. |
| Datos de estabilidad y seguridad | Garantiza la adecuación al mercado | Realiza pruebas y emite informes. |
| Cumplimiento del etiquetado | Aprobación final de la etiqueta | Revisión de ilustraciones y orientación sobre formato |
| Preparación para auditorías minoristas | Retención de documentos | Suministro y actualización de documentos |
| Cumplimiento y retiradas | Responsabilidad financiera y legal | Apoyo a la investigación técnica |
Aclaración clave:
Los fabricantes de equipos originales (OEM) facilitan el cumplimiento normativo, pero los importadores asumen el riesgo regulatorio a menos que la responsabilidad se reasigne contractualmente. Esta distinción es fundamental para los resultados de las auditorías y la exposición posterior a la comercialización.
Lo que realmente hace un BUEN OEM durante una auditoría
En RUIQIGO, Las auditorías no se consideran eventos documentales. Nuestros equipos OEM diseñan sistemas de fabricación en función de los puntos de control regulatorios desde el primer día, integrando la trazabilidad de los lotes, el control activo y la verificación del cumplimiento directamente en la producción diaria.
Flujo de trabajo de cumplimiento de OEM (ejecución real)
Durante una auditoría, los fabricantes de equipos originales (OEM) competentes demuestran el cumplimiento mediante el control de procesos, no mediante trámites reactivos. Los auditores evalúan si los sistemas están integrados en las operaciones diarias de fabricación.
- Validación de formulación en banco
Las formulaciones se validan a escala de laboratorio para confirmar las concentraciones activas, el rango de pH y la compatibilidad de los ingredientes antes de ampliar la escala.
- Estabilidad acelerada + en tiempo real
La estabilidad acelerada facilita las presentaciones tempranas, mientras que los estudios en tiempo real se ejecutan en paralelo para validar la vida útil y detectar la deriva de la formulación.
- Creación de hojas por lotes
Cada ejecución de producción está respaldada por hojas de lote que documentan las materias primas, los parámetros del proceso, los controles durante el proceso y los códigos de lote.
- Pruebas microbianas y químicas
Los productos terminados se someten a pruebas microbianas y verificación química para confirmar la seguridad, el rendimiento del conservante y el cumplimiento de los ingredientes activos.
- Emisión de CoA
Se emiten certificados de análisis específicos para cada lote y se verifican con las especificaciones antes de su liberación.
- Documentación de exportación y aduanas
Los documentos de envío, las declaraciones y los archivos de cumplimiento se alinean con los datos de los productos registrados para evitar discrepancias aduaneras.
Cómo fracasan los fabricantes de bajo nivel
Los fallos de auditoría a menudo se deben a debilidades sistémicas más que a errores aislados. Fabricantes de bajo nivel Por lo general, carecen de infraestructura de cumplimiento y responden solo cuando surgen problemas.
- Falta trazabilidad de lotes
Los registros de lotes inadecuados o inconsistentes impiden retiros efectivos y minan inmediatamente la confianza del auditor.
- Reutilización genérica de SDS
Los archivos SDS reciclados o no específicos del lote indican un control deficiente de la formulación y se marcan con frecuencia durante las auditorías.
- No hay revisión de riesgos de reclamaciones
Los fabricantes que no evalúan el riesgo regulatorio vinculado a las afirmaciones de marketing exponen a las marcas a una clasificación errónea y a medidas coercitivas.
- Cumplimiento reactivo (no proactivo)
El cumplimiento se trata como una solicitud de documento de último momento en lugar de un sistema de fabricación integrado, lo que genera demoras, acciones correctivas y auditorías fallidas.
Caja para llevar OEM:
Los fallos de cumplimiento son fallos de fabricación, no problemas de papeleo. Los auditores penalizan los sistemas deficientes, no los archivos faltantes.
CTA #2 de mitad de artículo: Solicitar llamada de consulta sobre RP/MoCRA
Aclare la responsabilidad del importador, los riesgos de clasificación del producto y las lagunas de documentación con un especialista en cumplimiento antes de la presentación o el envío reglamentario.
Cronograma de auditoría visualizado (opcional, pero eficaz)
Los plazos de auditoría varían según la región, pero los retrasos se producen constantemente en los mismos puntos de ejecución: decisiones de clasificación, documentación incompleta y correcciones de etiquetado en etapas finales. Comprender dónde se pierde tiempo permite a las marcas planificar los lanzamientos de forma realista y evitar bloqueos de inventario.

Marcador visual #3: Gráfico de cronograma de auditoría (EE. UU. vs. UE vs. Oriente Medio)
Comparación del cronograma de auditorías de cuidado bucal
| Etapa de auditoría | Estados Unidos (FDA/MoCRA) | Unión Europea (CPNP/PIF) | Oriente Medio (GSO 1943) |
| Clasificación de productos | Decisión sobre cosméticos y medicamentos de venta libre | Clasificación de cosméticos | Clasificación de cosméticos |
| Calificación de instalaciones/OEM | Registro de instalaciones | Calificación OEM a través de RP | Revisión de datos OEM |
| Revisión de seguridad y estabilidad | Pre-mercado limitado | Revisión de estabilidad y CPSR | Revisión de estabilidad |
| Revisión de reclamaciones y etiquetado | Moderado | Estricto, pre-mercado | Estricto, pre-mercado |
| Registro/notificación | Listado de productos | Notificación del CPNP | Registro de producto |
| Despacho de aduana | Cumplimiento posterior a la comercialización | Mínimo en la frontera | Alta aplicación de la ley |
| Entrada al mercado | Entrada anticipada permitida | Entrada después de la aprobación | Entrada después de la aprobación |
| Cumplimiento posterior a la comercialización | Alto | Moderado | Bajo-Moderado |
Conclusión del OEM:
El tiempo de comercialización se reduce mediante flujos de trabajo de cumplimiento paralelos, no saltándose pasos.
Conclusión (Cierre Comercial)
El éxito a largo plazo en el cuidado bucal depende de sistemas estructurados, no de trámites reactivos. Las marcas que consideran las auditorías y el cumplimiento normativo de sus productos de cuidado bucal como una disciplina de fabricación, no como una tarea de presentación, protegen los márgenes, los plazos y la confianza de los minoristas. Para las marcas que amplían sus SKU de pasta de dientes, enjuague bucal o blanqueador, Oralabx actúa como socio en la ejecución del cumplimiento normativo, alineando los sistemas de formulación, documentación y lotes con las realidades de las auditorías en EE. UU., la UE y Oriente Medio, de modo que la aprobación regulatoria se traduzca en un acceso predecible al mercado.
Preguntas frecuentes
P1. ¿Quién es legalmente responsable si falla una auditoría de cuidado bucal: el importador o el fabricante de equipos originales (OEM)?
El importador es legalmente responsable por defecto. Los fabricantes de equipos originales (OEM) pueden apoyar la ejecución del cumplimiento, pero la responsabilidad solo se transfiere si se reasigna explícitamente por contrato y es aceptada por los reguladores.
P2. ¿Los paquetes individuales de enjuague bucal requieren documentación de cumplimiento completa?
Sí. Los formatos de sobre no están exentos. Los auditores evalúan la formulación, las afirmaciones y los datos de seguridad independientemente del tamaño del envase.
P3. ¿Se pueden enviar muestras de enjuague bucal en sobres individuales sin SDS ni CoA?
En la mayoría de los casos, no. Las muestras pueden circular con algunas excepciones, pero las FDS y el Certificado de Acreditación (CoA) suelen exigirse en la aduana, especialmente para productos líquidos de higiene bucal.
P4. ¿Cuánto tiempo antes del lanzamiento se debe comenzar el trabajo de cumplimiento?
Lo ideal es hacerlo de 3 a 6 meses antes del lanzamiento. Los productos con principios activos o propiedades blanqueadoras deberían comenzar a planificar su cumplimiento incluso antes.
P5. ¿Los listados de Amazon requieren un certificado de autenticidad o una hoja de datos de seguridad (SDS)?
Amazon solicita con frecuencia CoA, SDS y documentos de cumplimiento durante la aprobación de listados o auditorías posteriores al listado, en particular para productos de cuidado bucal.
P6. ¿Qué documentos se deben conservar a nivel minorista?
Los minoristas generalmente requieren acceso a CoA, SDS, registros de trazabilidad de lotes y prueba de autorización de comercialización cuando se les solicita.
P7. ¿Se consideran las afirmaciones sobre blanqueamiento como medicamentos en EE. UU.?
Pueden. Las afirmaciones que implican blanqueamiento permanente, alteración del esmalte o efectos terapéuticos a menudo desencadenan un escrutinio a nivel farmacológico.
P8. ¿Puede una Persona Responsable de la UE gestionar también los mercados del CCG?
No. Los mercados del CCG requieren procesos de registro y cumplimiento locales separados; un RP de la UE no cubre automáticamente las obligaciones regulatorias de Medio Oriente.
CTA final: Lista de verificación de cumplimiento (PDF)
Evite retrasos en auditorías, costos de reetiquetado y retenciones en aduanas.
Descargue nuestra Lista de verificación de cumplimiento del cuidado bucal en formato PDF o hable directamente con un Especialista en cumplimiento de OEM para validar su documentación antes del lanzamiento.







