導入
このガイドは、歯磨き粉、マウスウォッシュ、ホワイトニング製品の調達を担当する調達リーダー、ブランド創設者、コンプライアンス管理者を対象としています。これらの担当者は、オーラルケア製品のSKU承認取得と店頭展開に責任を負っています。オーラルケア製品の発売遅延、通関保留、ラベル再貼付費用、そして小売市場への導入失敗の主な原因は、処方品質ではなく、監査とコンプライアンスです。.

口腔ケアの顔 有効成分、クレーム、バッチトレーサビリティなど、一般的な化粧品よりも厳格な審査が行われます。また、4週間の通関保留により、最低発注量(MOQ)が6桁に達する可能性があります。この記事では、地域ごとの監査ロジック、オーラルケア製品特有の要件、そしてOEMと輸入業者の明確な責任について解説します。.
で オララブックス, 、私たちは特にこの失敗ポイント、つまり処方は準備ができていても、コンプライアンスの実行によって SKU が実際に市場に届くかどうかが決まるポイントでブランドと協力します。.
口腔ケア監査の実際の仕組み(必須 vs 任意)
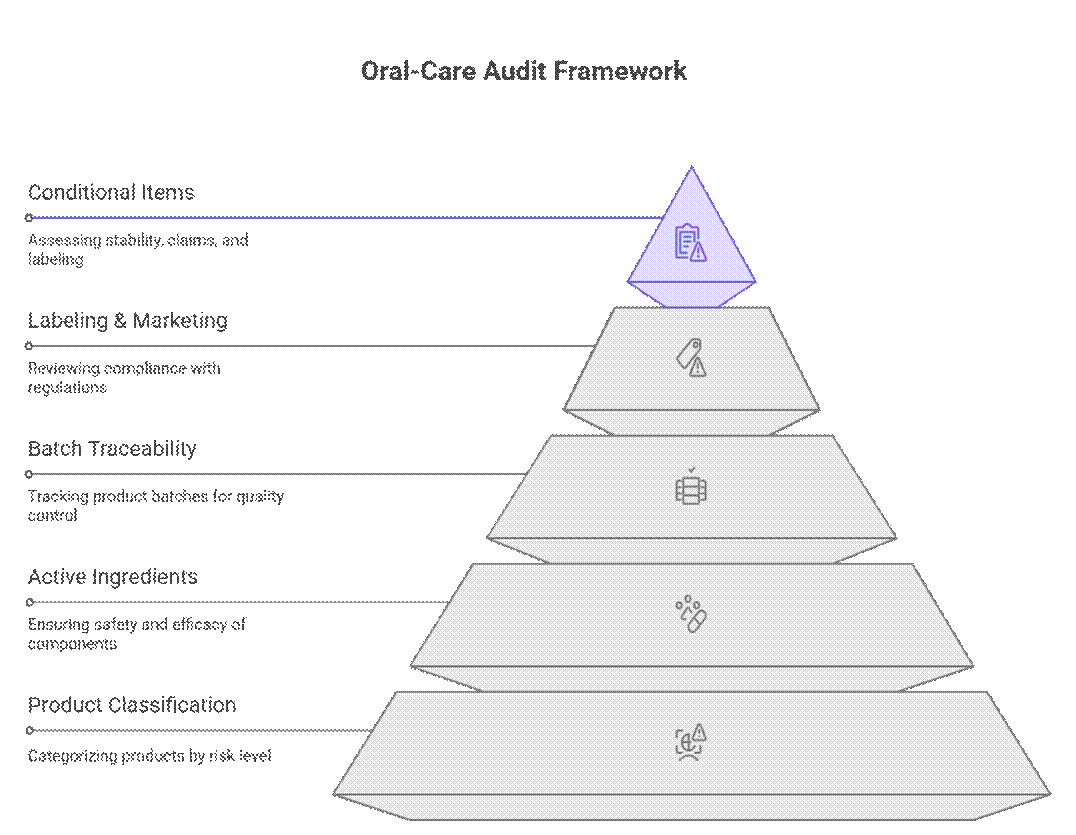
規制当局は、オーラルケア製品の監査とコンプライアンスにおいて、製品分類、有効成分、バッチトレーサビリティを優先する段階的なリスクベースのフレームワークを用いています。これらの要件を満たした上で初めて、安定性期間、効能・効果の裏付け、移行期間の表示といった条件付き項目の審査が行われます。.
監査人が最初にチェックするもの(交渉不可)
監査人は、さらなるレビューを進める前に満たさなければならない厳格な一連の要件から始めます。.
- 製品分類(化粧品 vs OTC/医薬部外品)
誤分類は、歯磨き粉の監査要件において最もよくある失敗の 1 つであり、特にブランドが、有効成分や主張に関連する化粧品と OTC の閾値をオーラルケア製品の分類で誤解している場合によく発生します。.
- 有効成分閾値
フッ化物や CPC などの成分の制限に準拠しているかどうかを確認します。これは、OTC または医薬品レベルの監視のきっかけとなる可能性があります。.
- 製造業者登録とGMPステータス
OEM施設が適切に登録され、承認されたGMP基準に従って運営されていることを確認します。 オーラルケア製品の製造.
- バッチトレーサビリティとリコール準備
規制当局や小売業者の要求に応じて製品を迅速に追跡、分離、回収できるように、完全なバッチ記録が存在することを確認します。.
条件付きで必要なもの
監査人は、交渉不可能な事項に加えて、文書化とテストに対してリスクベースのレビューを実施します。実施方法は市場や製品リスクによって異なりますが、不備があると承認の遅延や条件付き承認につながることがよくあります。.
- 安定期間(加速 vs. リアルタイム)
早期発売や低リスクの発売であれば、加速安定性で十分かもしれませんが、有効成分を含む製品、より長い保存期間を持つ製品、あるいはEUやGCCのような厳格な市場においては、リアルタイム安定性が求められることがよくあります。強力なOEMは、リアルタイム安定性と並行して運用しています。.
- 主張の裏付けの深さ
基本的な化粧品に関する主張は通常、最小限の根拠で済みますが、機能性に関する主張にはラボデータや臨床データが必要です。監査担当者は、証拠が不足している主張や最終的な処方と一致しない主張にはフラグを立てます。.
- 現地の言語とラベルの形式
英語のラベルは審査には有効ですが、最終承認には通常、現地語に準拠したラベル表示が必要です。監査員は、サブラベルの欠落、原材料名の誤り、または表示内容の翻訳ミスを指摘することがよくあります。.
交渉可能なもの(強力なOEMの場合)
規制は厳格に見えるかもしれませんが、経験豊富な監査人は製造現場の現実を理解しています。実績のあるOEMと明確なコンプライアンスロードマップがあれば、市場参入を妨げることなく、一部の要件を段階的に、あるいは段階的に適用していくことが可能です。.

- 遷移的ラベル付け
最終アートワークが承認され、スケジュールが組まれている場合、監査人は初期ロットの暫定ラベルを承認することがあります。強力なOEMはバッチの分離を徹底し、最終版以外のラベルが小売店に流通するのを防止しています。.
- スケールアップ中の段階的なドキュメント作成
最終アートワークが承認され、スケジュールが組まれている場合、監査人は初期ロットの暫定ラベルを承認することがあります。強力なOEMはバッチの分離を徹底し、最終版以外のラベルが小売店に流通するのを防止しています。.
- パイロット実行中の並行テスト
有力な OEM は、パイロット バッチ中に安定性、微生物、パッケージングのテストを実行し、発売までの期間を数週間または数か月短縮します。.
ビジュアルプレースホルダー #1: 監査要件階層(オーラルケア製品)
| 監査の優先度 | 要件カテゴリ | 含まれるもの | 欠落した場合の監査への影響 |
| レベル1 — 交渉不可 | 製品分類 | 化粧品とOTC/医薬部外品の判定、有効成分の閾値 | 即時監査不合格または税関保留 |
| GMPと施設のステータス | ISO 22716、FDA登録、衛生管理 | 出荷拒否、工場不適格 | |
| バッチトレーサビリティ | バッチ記録、リコール準備、ロットコード | 強制的な是正措置、リコールの可能性 | |
| レベル2 — 条件付きで必須 | 安定性サポート | 保存期間に関連した加速安定性および/またはリアルタイム安定性 | 条件付き承認、市販後義務 |
| 主張の裏付け | ホワイトニング、フッ素、歯垢、CPCの主張を裏付けるデータ | クレームの削除または再ラベル付けが必要 | |
| ローカルラベルコンプライアンス | 言語、形式、成分の命名規則 | 再ラベル費用、発売遅延 | |
| レベル 3 — 交渉可能 (OEM に依存) | 遷移的ラベル付け | 承認された最終バージョンがファイルに保存されている暫定アートワーク | 文書化されたサンセットプランで承認 |
| 段階的なドキュメント | スケールアップ中の長期テストの延期 | リスク評価とスケジュールが立てられていれば受け入れられる | |
| 並列テスト | パイロットラン中の安定性および微生物試験 | 強力なバッチ管理で承認済み |
OEM のポイント:
ブランドは、レベル2およびレベル3の項目を管理されたリスクではなく、任意の推測として扱うことで監査に合格しません。優れたOEMは、この階層を積極的に管理します。.
オーラルケア特有の監査項目ブランドが見逃している
オーラルケア監査の不合格の多くは、認証書の不足が原因ではありません。ブランドが、有効成分、機能性表示、日常使用といったリスクの高い製品に、一般的な化粧品の想定を当てはめてしまうことで発生します。.

監査人は早い段階でこれらの口腔ケア特有の詳細に焦点を当てており、ギャップがあると遅延、再ラベル付け、または是正措置が必要になることがよくあります。.
歯磨き粉特有の監査項目
歯磨き粉は、有効成分や治療効果を謳っているため、より積極的に監査を受けます。.
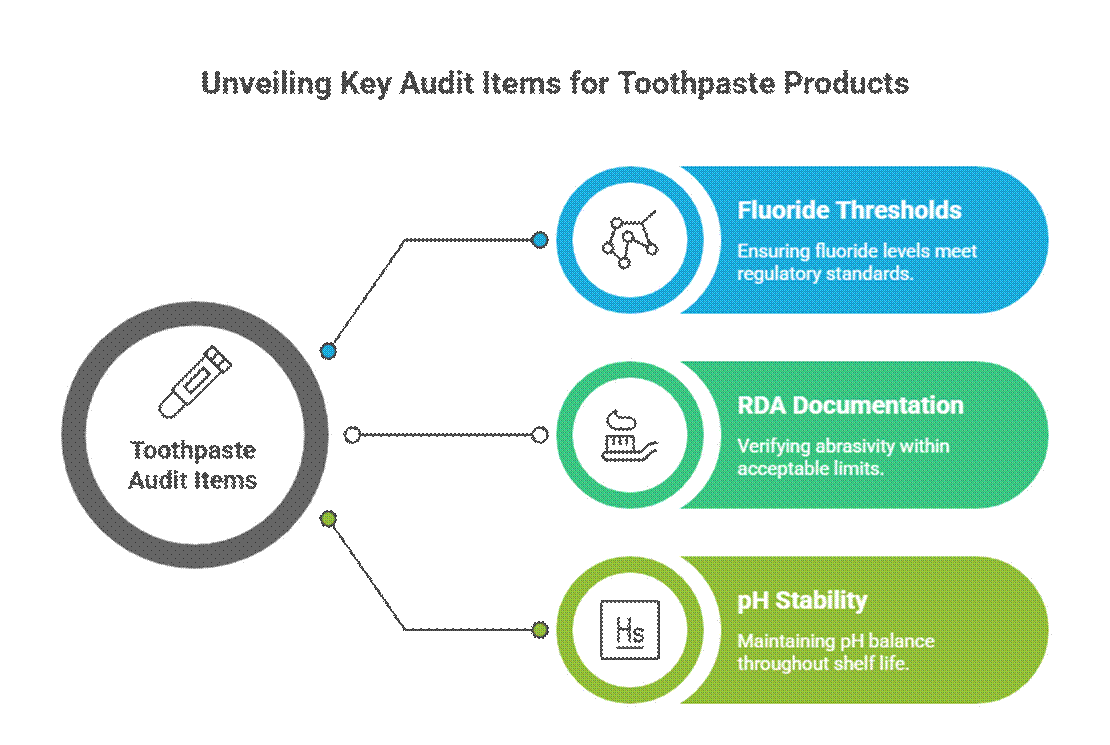
- フッ化物閾値(FDAモノグラフの関連性)
アメリカでは、, フッ化物配合歯磨き粉 フッ化物配合歯磨き粉に関するFDAモノグラフ(有効成分濃度、ラベル形式、表示内容の整合性を含む)に準拠する必要があります。監査人はまた、歯磨き粉に関するRDA(推奨摂取量)文書の提出と、有効期間全体にわたる検証済みの口腔ケア安定性試験の要件も求めています。.
- RDA文書(研磨性限界)
監査人は、エナメル質の安全性を確認するために、相対象牙質研磨性(RDA)データを求めています。RDA値が不足している、または過剰である場合は、特にホワイトニング剤や炭配合製品の場合、よくある危険信号です。.
- 保存期間中のpH安定性
歯磨き粉のpHは、使用期限を通して安全かつ機能的な範囲内に維持されなければなりません。監査員は安定性データを検査し、pHの変化がフッ化物の効果や口腔安全性を損なわないことを確認します。.
マウスウォッシュ特有の監査項目
マウスウォッシュのコンプライアンス監査 特に、CPC マウスウォッシュのコンプライアンス文書と防腐剤の有効性試験を必要とする処方については、微生物制御と活性濃度に重点を置いています。.
- アルコールフリーとアルコール含有の分類
歯磨き粉は、有効成分や治療効果を謳っているため、より積極的に監査を受けます。.
- CPC % ドキュメント
監査人は、CPC を含む式の濃度制限とクレームの整合性をチェックします。.
- 微生物チャレンジ試験報告書
チャレンジ テストが欠落しているか古くなっていると、条件付きの承認になることがよくあります。.
- 防腐剤効力試験
防腐剤の効果が弱い場合は、製品の安全性に関するリスクとして扱われます。.
美白製品の注意点
監査人は、ホワイトニング歯磨き粉の規制上の主張、特にエナメル質の変化、永久的なホワイトニング、または薬物レベルの監視を引き起こす可能性のある治療結果を暗示する文言を綿密に検査します。.

- 美白効果の主張と医薬品の主張(米国)
エナメル質の変化または治療結果を暗示する主張は、薬物分類のきっかけとなる可能性があります。.
- 過酸化物/非過酸化物の開示
監査人は、美白成分と濃度の明確な開示を要求します。.
- 規制当局の審査を誘発するクレーム文言
監査人は、美白成分と濃度の明確な開示を要求します。.
OEM のポイント:
オーラルケア監査はパッケージの美しさではなく、有効成分と主張の点で不合格となります。.
記事中段のCTA #1: サンプルコンプライアンスパックをダウンロード
MOQ を確定したり市場投入を確定したりする前に、匿名化された監査対応の OEM ドキュメントを確認します。.
地域監査フレームワーク(実行重視)
監査は地域によって異なりますが、その論理は一貫しています。規制当局はまず製品リスクを評価し、次に文書化、最後にラベル表示を評価します。異なるのは、執行が行われる場所です。.
米国 — FDAおよびMoCRA
米国の執行はますますFDAの口腔ケア監査要件に重点を置くようになり、 MoCRA口腔ケアコンプライアンス オーラルケアブランドの市販後責任の拡大。.
- 化粧品 vs. 市販薬の決定木
誤分類は強制執行の一般的なきっかけとなります。.
- 施設登録と製品掲載
監査人は、MoCRA 登録の正確性と SKU の整合性を検証します。.
- バッチ記録と有害事象への備え
ブランドは追跡可能性と苦情処理システムを実証する必要があります。.
- 美白効果の主張:ブランドが一線を越えるところ
誇張された美白効果の主張は、しばしば薬物検査のきっかけとなります。.
欧州連合 — CPNPとPIF
CPNP および PIF による EU の口腔ケアコンプライアンスでは、口腔ケア製品の処方、ラベル、および CPSR 要件間の完全な整合性が求められ、責任は責任者に課せられます。.

- 責任者(RP)の役割
RP は完全な製品情報ファイルを制御およびアクセスする必要があります。.
- 安全性評価の期待
ジェネリック CPSR は、口腔ケア製品では頻繁に拒否されます。.
- 安定性、CPSR、ラベルチェック
ドキュメント間の不一致は、よくある失敗ポイントです。.
- 輸入業者の責任リスク
責任は OEM ではなく RP または輸入業者にあります。.
中東 — GSO 1943
GSO 1943 口腔ケア登録 税関に強制的な圧力がかかり、貨物の通関にはラベルの正確性と提出物の一貫性が重要になります。.
- 製品登録のタイムライン
提出が不完全な場合、プロセスがリセットされることがよくあります。.
- アラビア語の表示要件
アラビア語のサブラベルが欠落しているか間違っていると、出荷が保留されることがよくあります。.
- 税関押収の一般的な原因
提出後のラベルの変更とドキュメントの不一致。.
マイクロケース:書類の紛失によるEU税関の差し止め
欧州の販売代理店が、下位OEMが製造したフッ化物配合のホワイトニング歯磨き粉を輸入しました。処方自体は適合していましたが、製品情報ファイル(PIF)、安定性データ、および最終ラベル表示に不一致があったため、出荷は税関で差し止められました。CPSRは以前の処方バージョンを参照しており、リアルタイムの安定性試験は開始されておらず、ホワイトニング効果の謳い文句は安全性評価機関の承認値を上回っていました。.
その結果、4週間の通関保留、強制的なラベル再貼付、そして11,800ユーロの予定外のコストが発生し、在庫資本は遊休状態となりました。もし申請前に製剤バージョン、安定性プロトコル、そして効能の裏付けが確保されていれば、出荷は介入なく通関できたはずです。.
このため、経験豊富なオーラルケア OEM は、安定性テストを並行して実行し、PIF の確定前に処方バージョンを固定し、アートワークの承認前にクレームリスク レビューを実行して、監査人がすぐに警告するような文書の逸脱を防止します。.
責任の明確化
ISO 22716 オーラルケア製造によってサポートされている強力なオーラルケア OEM GMP 準拠により、監査人は是正措置やリコールを行わずにオーラルケアのバッチ トレーサビリティ要件を検証できます。.
Oralabx では、法的責任と実行サポートを明確に分離し、バッチ固有の監査対応ドキュメントを提供するとともに、分類やクレームのリスクが強制執行上の問題になる前にフラグを立てることで、ブランドをサポートしています。.
輸入業者とOEMの責任(明確化セクション)
オーラルケア監査に合格し、市販後責任を回避するには、明確な責任分担が不可欠です。規制当局は「意図」や非公式な合意を評価せず、誰が法的に責任を負い、誰が文書を管理しているかを評価します。役割が不明確な場合、たとえOEMがコンプライアンス関連業務の大部分を担っていたとしても、強制執行は輸入業者に委ねられます。.
輸入業者の法的責任
OEMのサポートの有無にかかわらず、規制当局は製品を市場に投入する当事者に最終的な責任を負わせます。輸入業者は、明示的な法的再委託なしにこれらの義務を外部委託することはできません。.

- 市場認可
販売前に法的承認を確実に取得します。.
- 請求承認
すべてのマーケティングおよびパッケージ上の主張は輸入業者の責任の対象となります。.
- 小売文書の保管
輸入業者は、PIF アクセス、CoA、SDS、バッチ トレーサビリティ レコードなどのコンプライアンス ドキュメントを保管し、要求に応じて作成する必要があります。.
有能なOEMが提供すべきもの
認定されたオーラルケア OEM は、各生産バッチに直接結び付けられた検証可能で監査対応可能なドキュメントを提供することで、コンプライアンスの実行をサポートします。.
- GMP認証
現在、, 地域認定GMP認証 (例: ISO 22716) 管理された製造、衛生、品質システムを実証します。.
- バッチ記録とトレーサビリティ
原材料、生産工程、完成品を結び付けるバッチ製造記録、ロットコード、リコール追跡可能性を完了します。.
- CoA、SDS、安定性および微生物レポート
最終配合に合わせたバッチ固有の分析証明書、安全データシート、安定性研究、微生物/チャレンジ試験レポート。.
- 輸出書類
登録された製品データおよびラベルと一致する正確な商業送り状、梱包明細書、申告書、および輸出関連書類。.
ビジュアルプレースホルダー #2: 輸入業者とOEMの責任表
この表は、口腔ケア監査中に規制当局がどのように責任を割り当てるか、および OEM サポートが終了して法的責任が開始する場所を明確に示しています。.
輸入業者とOEMの責任(オーラルケアコンプライアンス)
| コンプライアンス領域 | 輸入者(法的責任) | OEM(実行サポート) |
| 製品分類 | 最終分類決定 | 処方入力とリスクフラグ |
| 市場認可 | 登録、通知、RP予約 | データと文書の準備 |
| 請求承認 | 合法性と裏付けを主張する | クレームリスクレビューとデータサポート |
| GMP準拠 | OEM資格を検証 | GMPシステムと監査を維持する |
| バッチトレーサビリティ | 記録を保存し、作成する | バッチレコードとロットコードを作成します |
| 安定性と安全性データ | 市場の適切性を保証する | テストを実施し、レポートを発行する |
| ラベルコンプライアンス | 最終ラベル承認 | アートワークのレビューとフォーマットのガイダンス |
| 小売監査の準備 | 文書保管 | 文書の提供と更新 |
| 執行とリコール | 財務および法的責任 | 技術調査サポート |
重要な説明:
OEMはコンプライアンス遵守を実現しますが、契約上責任が再割り当てされない限り、輸入業者が規制リスクを負います。この区別は、監査結果と市販後のリスク管理において重要です。.
監査中に優れたOEMが実際に行う事
で ルイキゴ, 監査は文書イベントとして扱われません。当社のOEMチームは、製造システムを初日から規制チェックポイントを中心に設計し、バッチトレーサビリティ、アクティブコントロール、コンプライアンス検証を日々の生産プロセスに直接組み込みます。.
OEMコンプライアンスワークフロー(実際の実行)
監査において、有能なOEMは、事後対応的な書類処理ではなく、プロセス管理を通じてコンプライアンスを実証します。監査人は、システムが日常の製造業務に組み込まれているかどうかを評価します。.
- ベンチ配合検証
スケールアップ前に、有効濃度、pH 範囲、成分の適合性を確認するために、配合はベンチ スケールで検証されます。.
- 加速+リアルタイム安定性
加速された安定性により早期の申請がサポートされる一方で、リアルタイムの研究が並行して実行され、保存期間を検証し、処方のドリフトを検出します。.
- バッチシート作成
各生産実行は、原材料、プロセスパラメータ、工程内制御、ロットコードを文書化したバッチシートによってサポートされます。.
- 微生物および化学検査
完成品は、安全性、防腐性能、有効成分の適合性を確認するために、微生物検査と化学検証を受けます。.
- CoA発行
バッチ固有の分析証明書が発行され、リリース前に仕様と照合されます。.
- 輸出および通関書類
出荷書類、申告書、コンプライアンス ファイルは登録された製品データと整合され、税関の不一致を防止します。.
低レベルメーカーの失敗の理由
監査の失敗は、多くの場合、個別のミスではなく、システム全体の弱点に起因します。. 下位メーカー 通常、コンプライアンス インフラストラクチャが不足しており、問題が表面化した場合にのみ対応します。.
- バッチトレーサビリティの欠如
不十分または一貫性のないバッチ記録は、効果的なリコールを妨げ、監査人の信頼を直ちに損ないます。.
- 汎用SDSの再利用
リサイクルされた、またはバッチ固有ではない SDS ファイルは、配合管理が不十分であることを示しており、監査中に頻繁にフラグが立てられます。.
- 請求リスクレビューなし
マーケティング主張に関連する規制リスクを評価しないメーカーは、ブランドを誤分類および強制措置の対象にさらします。.
- 受動的な(能動的なではない)コンプライアンス
コンプライアンスは、統合された製造システムではなく、土壇場での文書要求として扱われ、遅延、是正措置、監査の失敗につながります。.
OEMテイクアウトボックス:
コンプライアンス違反は製造上の欠陥であり、書類の問題ではありません。監査人が罰するのはシステムの脆弱性であり、ファイルの紛失ではありません。.
記事中CTA #2: RP / MoCRA相談コールのリクエスト
規制当局への提出や出荷の前に、コンプライアンス専門家と協力して、輸入業者の責任、製品分類のリスク、文書のギャップを明確にします。.
視覚化された監査タイムライン(オプションだが強力)
監査のタイムラインは地域によって異なりますが、遅延は一貫して同じ実行ポイント、つまり分類決定、文書の不備、そして最終段階でのラベル修正で発生します。実際に時間が失われている場所を理解することで、ブランドは現実的な発売計画を立て、在庫の滞留を回避することができます。.

ビジュアルプレースホルダー #3: 監査タイムラインチャート (米国 vs EU vs 中東)
口腔ケア監査のタイムライン比較
| 監査段階 | 米国(FDA / MoCRA) | 欧州連合(CPNP / PIF) | 中東(GSO 1943) |
| 製品分類 | 化粧品か市販薬かの判断 | 化粧品の分類 | 化粧品の分類 |
| 施設/OEM認定 | 施設登録 | RPによるOEM認定 | OEMデータレビュー |
| 安全性と安定性のレビュー | 限定的なプレマーケット | CPSR + 安定性レビュー | 安定性レビュー |
| 主張とラベルの見直し | 適度 | 厳格な市場前 | 厳格な市場前 |
| 登録・通知 | 製品リスト | CPNP通知 | 製品登録 |
| 通関 | 市販後調査の執行 | 国境では最小限 | 厳格な執行 |
| 市場参入 | 早期入場可 | 承認後の入国 | 承認後の入国 |
| 市販後調査の執行 | 高い | 適度 | 低~中程度 |
OEM のポイント:
市場投入までの時間は、手順を省略するのではなく、並行したコンプライアンス ワークフローによって短縮されます。.
結論(コマーシャルクローズ)
オーラルケアにおける長期的な成功は、事後対応型の書類作業ではなく、構造化されたシステムの構築にかかっています。オーラルケア製品の監査とコンプライアンスを、単なる申請業務ではなく、製造工程として捉えるブランドは、利益率、納期、そして小売業者からの信頼を守ることができます。歯磨き粉、マウスウォッシュ、ホワイトニング製品のSKU(在庫管理単位)を拡大するブランドにとって、Oralabxはコンプライアンス実行パートナーとして、処方、文書管理、バッチシステムを調整し、米国、EU、中東における現状を監査することで、規制当局の承認を予測可能な市場アクセスへと転換します。.
よくある質問
Q1. オーラルケア監査に不合格になった場合、法的責任を負うのは輸入業者ですか、それともOEMですか?
輸入業者は、デフォルトで法的責任を負います。OEMはコンプライアンスの履行をサポートできますが、責任の移転は契約で明示的に再割り当てされ、規制当局によって承認された場合にのみ行われます。.
Q2. 1袋入りのマウスウォッシュSKUには、完全なコンプライアンス文書が必要ですか?
はい。サシェ包装も例外ではありません。監査員は、包装サイズに関わらず、配合、表示、安全性データを評価します。.
Q3. 1袋入りのマウスウォッシュのサンプルはSDSやCoAなしで発送できますか?
ほとんどの場合、必要ありません。サンプルは限られた例外の下で輸送できますが、特に液体のオーラルケア製品の場合、税関でSDSとCoAが要求されることがよくあります。.
Q4. コンプライアンス作業は発売のどれくらい前に開始する必要がありますか?
理想的には発売の3~6か月前です。有効成分や美白効果を謳う製品の場合は、さらに早い段階でコンプライアンス計画を開始する必要があります。.
Q5. Amazon 出品には CoA または SDS が必要ですか?
Amazon では、特にオーラルケア製品の場合、出品承認時または出品後監査時に、CoA、SDS、コンプライアンス文書の提出を頻繁に要求します。.
Q6. 小売業者レベルで保管する必要がある文書は何ですか?
小売業者は通常、要求に応じて、CoA、SDS、バッチ追跡記録、および市場承認の証明へのアクセスを要求します。.
Q7. 米国ではホワイトニング効果の主張は医薬品として扱われますか?
可能です。永久的なホワイトニング、エナメル質の変化、あるいは治療効果を暗示する主張は、多くの場合、薬物レベルの精査の対象となります。.
Q8. EU責任者はGCC市場も担当できますか?
いいえ。GCC 市場では、別途現地での登録およびコンプライアンス プロセスが必要です。EU RP では中東の規制義務が自動的にカバーされるわけではありません。.
最終 CTA: コンプライアンス チェックリスト PDF
監査の遅延、ラベル再作成コスト、通関保留を回避します。.
口腔ケアコンプライアンスチェックリストPDFをダウンロードするか、直接お問い合わせください。 OEMコンプライアンススペシャリスト リリース前にドキュメントを検証します。.







